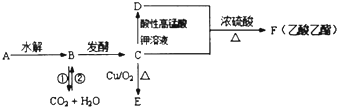
题目内容
15. 储氢材料的种类很多,包括储氢合金、配位氢化物、碳质吸附材料等.
储氢材料的种类很多,包括储氢合金、配位氢化物、碳质吸附材料等.(1)TiFe合金是钛系储氢合金的代表,该合金具有放氢温度低、价格适中等优点.
①基态Fe原子的价电子排布式为3d64s2.
②基态Ti原子含有7种不同能级的电子.
(2)NaH、MgH2、AlH3足良好的吸氢材料.Na、Mg、Al原子的第一电离能由小到大的顺序为Mg>Al>Na(填元索符号).
(3)配位氢化物NaAlH4储氢性能好,AlH4-的立体构型是正四面体.
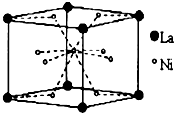
(4)鑭镍合金是目前广泛使用的储氢材料,其晶胞结构如图,Ni原子处于晶胞的面上和体心.
①该晶体的化学式为LaNi5;
②若该晶胞为立方体,合金的平均摩尔质量为Mg•mol-1,密度为ag•cm-3,则两个距离最近
的La原子间的距离为$\root{3}{\frac{M}{a{N}_{A}}}$cm.(用含a、M的表达式表示)
分析 (1)①Fe是26号元素,价电子数为8,根据原子核外电子排布规律排布;
②Ti是22号元素,原子核外有spd等能级;
(2)同周期随原子序数增大,第一电离能呈增大趋势,元素原子各轨道为半满、全满、全空时,能量较低,第一电离能高于同周期相邻元素的;
(3)根据价层电子对互斥理论确定空间构型;
(4)①根据均摊法计算出晶胞中各原子的个数,再确定化学式;
②根据V=$\frac{m}{ρ}$计算出晶胞的体积,进而计算出晶胞的边长,根据晶胞图可知,两个距离最近的La原子间的距离为晶胞的边长.
解答 解:(1)①Fe是26号元素,位于元素周期表中第四周期第ⅥB族,故Ti的基态原子价电子排布式为 3d64s2,故答案为:3d64s2;
②Ti是22号元素,原子核外有1s、2s、3s、4s、2p、3p、3d等7个能级,故答案为:7;
(2)同周期随原子序数增大,第一电离能呈增大趋势,Mg元素原子2s轨道为全满稳定状态,能量较低,第一电离能高于同周期相邻元素的,故第一电离能:Mg>Al>Na,
故答案为:Mg>Al>Na;
(3)AlH4-中Al原子价层电子对=4+$\frac{1}{2}$(3+1-4)=4,且没有孤电子对,所以是正四面体结构,故答案为:正四面体;
(4)①根据均摊法可知,晶胞中La原子的个数为$8×\frac{1}{8}$=1,Ni原子个数为$8×\frac{1}{2}+1$=5,所化学式为LaNi5,
故答案为:LaNi5;
②根据V=$\frac{m}{ρ}$计算出晶胞的体积为$\frac{M}{a{N}_{A}}$cm3,所以晶胞的边长为$\root{3}{\frac{M}{a{N}_{A}}}$cm,根据晶胞图可知,两个距离最近的La原子间的距离为晶胞的边长,所以两个距离最近的La原子间的距离为$\root{3}{\frac{M}{a{N}_{A}}}$cm,
故答案为:$\root{3}{\frac{M}{a{N}_{A}}}$cm.
点评 本题考查物质结构和性质,涉及核外电子排布、空间构型的判断、晶胞的计算等知识点,难点是晶胞的计算,灵活运用公式是解本题关键,难度中等.

| 序号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ |
| 名称 | 甲烷 | 一氧化碳 | 乙烯 | 苯 | 甲苯 | 苯酚 | 氨水 |
(2)能与溴水反应使之褪色的烃是(填序号):③.
(3)能发生加聚反应、生成物可用作制造食品包装袋的是(填序号)③,该物质发生加聚反应的化学方程式为nCH2=CH2$\stackrel{催化剂}{→}$

(4)能使酸性高锰酸钾褪色的烃是(填结构简)CH2=CH2、
 、
、 .
.(4)彼此互为同系物的是(填序号):④⑤.
(5)甲苯的一氯取代产物的有4种,请写出甲苯的一氯取代产物结构简式:
 .
. | A. | 强碱性溶液中:K+、Al3+、Cl-、SO42- | |
| B. | 水电离出来的c(H+)=10-13mol/L的溶液:K+、HCO3-、Br-、Ba2+ | |
| C. | 所含溶质为Na2SO4的溶液:K+、CO32-、NO3-、Al3+ | |
| D. | 室温下,pH=1的溶液中:Na+、Fe3+、NO3-、SO42- |
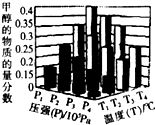 反应3H2(g)+CO2(g)?CH3OH(g)+H20(g)△H<0,在一定条件下达到平衡时,改变温度(T)和压强(P),CH3OH物质的量分数的变化情况如图所示,
反应3H2(g)+CO2(g)?CH3OH(g)+H20(g)△H<0,在一定条件下达到平衡时,改变温度(T)和压强(P),CH3OH物质的量分数的变化情况如图所示,下列判断正确的是( )
| A. | P3>P2,T3>T2 | B. | P2>P4,T4>T2 | C. | P1>P3,T1>T3 | D. | P1>P4 T2<T3 |
| A. | 2 | B. | 3 | C. | 4 | D. | 5 |
| A. | 苯和溴用铁作催化剂生成溴苯 | |
| B. | 向苯酚浓溶液中滴入少量浓溴水可观察到白色三溴苯酚沉淀 | |
| C. | 氯乙烷与NaOH溶液共热,在水解后的溶液中加入硝酸酸化的AgNO3溶液检验Cl- | |
| D. | 向淀粉在酸性条件下水解的产物中加银氨溶液,水浴加热,检验葡萄糖的生成 |
| A. | 食用植物油水解均可生成甘油 | |
| B. | 聚丙烯能使溴水褪色 | |
| C. | 苯和浓硝酸反应生成硝基苯,乙酸和乙醇反应生成乙酸乙酯,二者反应类型相同 | |
| D. | 向蔗糖水解后的溶液中加新制的Cu(OH)2悬浊液,加热到沸腾即可验证水解产物葡萄糖 |
 外,还含有的官能团名称是碳碳双键和酯基;
外,还含有的官能团名称是碳碳双键和酯基; .
.