题目内容
【题目】早在1913年就有报道说,在400℃以上AgI晶体的导电能力是室温时的上万倍,可与电解质溶液相比。
(1)已知Ag元素的原子序数为47,则Ag元素在周期表中的位置是_____________,属于_____区,基态Ag原子的价电子排布式为__________。
(2)硫代硫酸银(Ag2S2O3)是微溶于水的白色化合物,它能溶于过量的硫代硫酸钠(Na2S2O3)溶液生成[Ag(S2O3)2]3-等络阴离子。在[Ag(S2O3)2]3-中配位原子是______(填名称),配体阴离子的空间构型是______,中心原子采用_____杂化。
(3)碘的最高价氧化物的水化物有HIO4(偏高碘酸,不稳定)和H5IO6(正高碘酸)等多种形式,它们的酸性HIO4_____ H5IO6(填:弱于、等于或强于)。氯、溴、碘的氢化物的酸性由强到弱排序为______(用化学式表示),其结构原因是______。
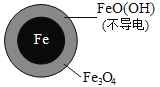
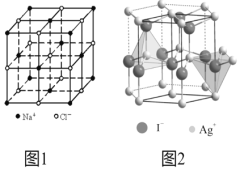
(4)在离子晶体中,当0.414<r(阳离子):r(阴离子)<0.732时,AB型化合物往往采用和NaCl晶体相同的晶体结构(如下图1)。已知r(Ag+):r(I-)=0.573,但在室温下,AgI的晶体结构如下图2所示,称为六方碘化银。I-的配位数为______,造成AgI晶体结构不同于NaCl晶体结构的原因不可能是_______。
a. 几何因素 b. 电荷因素 c. 键性因素
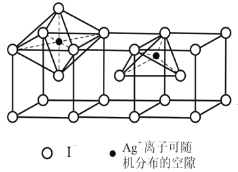
(5)当温度处于146~555℃间时,六方碘化银转化为α–AgI(如下图),Ag+可随机地分布在四面体空隙和八面体空隙中,多面体空隙间又彼此共面相连。因此可以想象,在电场作用下,Ag+可从一个空隙穿越到另一个空隙,沿着电场方向运动,这就不难理解α–AgI晶体是一个优良的离子导体了。则在α–AgI晶体中,n(Ag+)﹕n(八面体空隙)﹕n(四面体空隙)= ______________。
【答案】第五周期IB族 ds 4d105s1 硫 四面体形 sp3 强于 HI>HBr>HCl 氯、溴、碘的原子半径逐渐增大,H—Cl、 H—Br、 H—I的键长逐渐增大,共价键键能逐渐减弱,所以HI更容易电离出H+,酸性更强 4 ab 1﹕3﹕6
【解析】
根据同族元素来确定Ag元素的位置和价电子排布式;由价层电子对互斥理论确定杂化轨道和空间构型;含氧酸中非羟基氧原子个数越多酸性越强;四面体空隙:由四个球体围成的空隙,球体中心线围成四面体;八面体空隙:由六个球围成的空隙,球体中心线围成八面体形;根据均摊法确定离子个数、八面体空隙和四面体空隙的个数。
(1)已知Ag元素的原子序数为47,第四周期有18种元素,47-18=29,29号元素为Cu,则Ag元素在周期表中应在Cu的下方,Cu原子的价电子为3d104s1,Cu元素在第四周期IB族,属于ds区,所以则Ag元素在周期表中的位置是第五周期IB族,属于ds区,基态Ag原子的价电子排布式为4d105s1。
(2) 硫代硫酸根中因为硫比氧半径更大,所以与银离子的亲和性更好,所以[Ag(S2O3)2]3-中配位原子是硫;配体阴离子![]() -的中心原子是硫,另一个硫原子相当于氧原子,则中心原子硫的孤电子对数为
-的中心原子是硫,另一个硫原子相当于氧原子,则中心原子硫的孤电子对数为![]() ,价层电子对数为4+0=4,所以空间构型是四面体形,中心原子采用sp3杂化。
,价层电子对数为4+0=4,所以空间构型是四面体形,中心原子采用sp3杂化。
(3) H5IO6(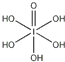 )中含有5个羟基氢,为五元酸,含非羟基氧原子1个,HIO4为一元酸,含有1个羟基氢,含非羟基氧原子3个,含非羟基氧原子个数越多酸性越强,所以酸性HIO4强于H5IO6;氯、溴、碘的氢化物为HCl、 HBr、 HI,由于氯、溴、碘的原子半径逐渐增大,H—Cl、 H—Br、 H—I的键长逐渐增大,共价键键能逐渐减弱,所以HI更容易电离出H+,酸性更强,故酸性由强到弱排序为HI>HBr>HCl;
)中含有5个羟基氢,为五元酸,含非羟基氧原子1个,HIO4为一元酸,含有1个羟基氢,含非羟基氧原子3个,含非羟基氧原子个数越多酸性越强,所以酸性HIO4强于H5IO6;氯、溴、碘的氢化物为HCl、 HBr、 HI,由于氯、溴、碘的原子半径逐渐增大,H—Cl、 H—Br、 H—I的键长逐渐增大,共价键键能逐渐减弱,所以HI更容易电离出H+,酸性更强,故酸性由强到弱排序为HI>HBr>HCl;
(4) 如下图2, 离I-最靠近的Ag+的有四个,所以I-配位数为4;由于r(Ag+):r(I-)=0.573,在0.414<r(阳离子):r(阴离子)<0.732范围内,但是晶体结构和NaCl晶体不同,所以a几何因素不可以作为晶体结构的原因;AgI和NaCl的阴阳离子的电荷比相同,所以b电荷因素不可以作为晶体结构的原因;Ag+和I-离子半径大,受相反电荷离子的电场作用变成椭球形,不再维持原来的球形,离子键就向共价键过渡,它们的成键具有离子键和共价键的双重特性,其离子键的纯粹程度不高,离子键的纯粹程度简称键性因素,所以造成AgI晶体结构不同于NaCl晶体结构的原因是键性因素,答案选ab。
离I-最靠近的Ag+的有四个,所以I-配位数为4;由于r(Ag+):r(I-)=0.573,在0.414<r(阳离子):r(阴离子)<0.732范围内,但是晶体结构和NaCl晶体不同,所以a几何因素不可以作为晶体结构的原因;AgI和NaCl的阴阳离子的电荷比相同,所以b电荷因素不可以作为晶体结构的原因;Ag+和I-离子半径大,受相反电荷离子的电场作用变成椭球形,不再维持原来的球形,离子键就向共价键过渡,它们的成键具有离子键和共价键的双重特性,其离子键的纯粹程度不高,离子键的纯粹程度简称键性因素,所以造成AgI晶体结构不同于NaCl晶体结构的原因是键性因素,答案选ab。
(5)如图取最小的单元,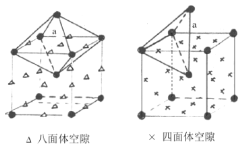 八面体空隙在面心(6个)和棱上(12个),有
八面体空隙在面心(6个)和棱上(12个),有![]() 个,四面体空隙在面心,每个面心四个,有
个,四面体空隙在面心,每个面心四个,有![]() 个,每个晶胞含有
个,每个晶胞含有![]() 个离子,则n(Ag+)﹕n(八面体空隙)﹕n(四面体空隙)=2﹕6﹕12= 1﹕3﹕6。
个离子,则n(Ag+)﹕n(八面体空隙)﹕n(四面体空隙)=2﹕6﹕12= 1﹕3﹕6。

 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案【题目】用零价铁(Fe)去除水体中的硝酸盐(NO3-)已成为环境修复研究的热点之一。
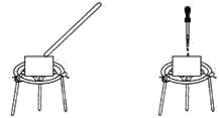
(1)Fe还原水体中NO3-的反应原理如图所示。
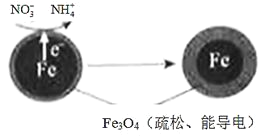
①作负极的物质是_________。
②正极的电极反应式是_________。
(2)将足量铁粉投入水体中,经24小时测定NO3-的去除率和pH,结果如下:
初始pH | pH=2.5 | pH=4.5 |
NO3-的去除率 | 接近100% | <50% |
24小时pH | 接近中性 | 接近中性 |
铁的最终物质形态 |
|
|
pH=4.5时,NO3-的去除率低。其原因是_________。
(3)其他条件与(2)相同,经1小时测定NO3-的去除率和pH,结果如下:
初始pH | pH=2.5 | pH=4.5 |
NO3-的去除率 | 约10% | 约3% |
1小时pH | 接近中性 | 接近中性 |
与(2)中数据对比,解释(2)中初始pH不同时,NO3-去除率和铁的最终物质形态不同的原因:_________。
【题目】(1)接触法制硫酸工艺中,其主反应是在恒容、温度为450℃并有催化剂存在的条件下进行:
2SO2(g)+O2(g) ![]() 2SO3(g) ΔH=-190Kj/mol
2SO3(g) ΔH=-190Kj/mol
①下列描述中能说明上述反应已达平衡的是____________。
a. ![]() (O2)正=2
(O2)正=2![]() (SO3)逆 b.容器中气体的密度不随时间而变化
(SO3)逆 b.容器中气体的密度不随时间而变化
c.容器中气体的平均相对分子质量不随时间而变化 d.容器中气体的分子总数不随时间而变化
②在一个固定容积为5L的密闭容器中充入0.20molSO2和0.10molO2,半分钟后达到平衡,测得容器中含SO30.18mol,则![]() (O2)=__________mol·L-1·min-1,若继续通入0.40 mol SO2和0.20molO2则平
(O2)=__________mol·L-1·min-1,若继续通入0.40 mol SO2和0.20molO2则平
衡______移动(填“向正反应方向”、“向逆反应方向”或“不”),再次达到平衡后,________mol3) <_____mol。
(2)工业生成尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为2NH3 (g)+ CO2(g) ![]() CO(NH2)2(1)+H2O(1),该反应的平衡常数和温度关系如下:
CO(NH2)2(1)+H2O(1),该反应的平衡常数和温度关系如下:
T/℃ | 165 | 175 | 185 | 195 |
K | 111.9 | 74.1 | 50.6 | 34.8 |
①ΔH_______0(填“>”、“<”或“=”)
②在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)![]() =x,下图是氨碳比(x)与CO2平衡转化率(α)的关系,α随着x增大而增大的原因是___________。
=x,下图是氨碳比(x)与CO2平衡转化率(α)的关系,α随着x增大而增大的原因是___________。

③右图中的B点对应的NH3的平衡转化率为___________。