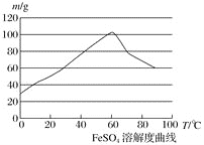
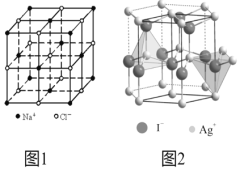
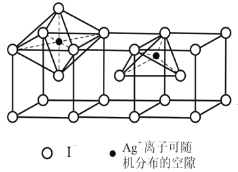
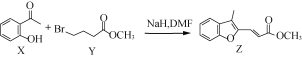题目内容
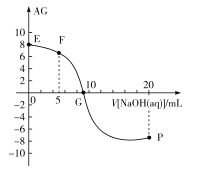
【题目】某化学兴趣小组在学校科技节活动中表演了“滴水生火”、“吹气生火”的小魔术。如图所示,在蒸发皿上放一小团脱脂棉,在里面裹入一种淡黄色的化合物,对着脱脂棉吹气或者用胶头滴管滴几滴水,一会儿脱脂棉会燃烧起来。
(1)淡黄色的化合物为___。
(2)由“滴水生火”的小魔术可以得出Na2O2和H2O发生反应的依据:a.有氧气生成;b.__。该反应的化学方程式是___。
(3)“吹气生火”的过程中发生的化学反应方程式为__,用双线桥标出反应中电子转移的方向和数目:___。
【答案】过氧化钠 有热量放出 2Na2O2+2H2O=4NaOH+O2↑ 2Na2O2+2CO2=2Na2CO3+O2 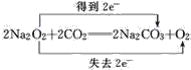
【解析】
过氧化钠能够与水或二氧化碳反应,放出大量的热,反应中过氧化钠既做氧化剂又做还原剂,据此进行分析。
(1)根据题中信息,得出淡黄色的化合物是Na2O2;
答案为:过氧化钠或Na2O2;
(2)燃烧的条件一般是一有氧气,二达到着火点,脱脂棉着火,根据信息,过氧化钠与H2O反应产生O2的同时有热量的放出,其反应方程式为2Na2O2+2H2O=4NaOH+O2↑;
答案为:有热量放出;2Na2O2+2H2O=4NaOH+O2↑;
(3)根据过氧化钠的化学性质,发生2Na2O2+2CO2=2Na2CO3+O2;过氧化钠与与CO2反应,Na2O2既是氧化剂又是还原剂,CO2均不参与氧化还原反应,即有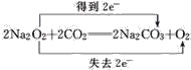 ;
;
答案为:2Na2O2+2H2O=4NaOH+O2↑、2Na2O2+2CO2=2Na2CO3+O2; 。
。

 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案【题目】已知:H2(g)+I2(g)![]() 2HI(g)△H=-14.9kJ·mol-1。某温度下,在体积均为2.0L的甲、乙两个恒容密闭容器中充入反应物,其起始物质的量如下表所示。甲中反应达到平衡时,测得c(H2)=0.008mol·L-1。下列判断正确的是( )
2HI(g)△H=-14.9kJ·mol-1。某温度下,在体积均为2.0L的甲、乙两个恒容密闭容器中充入反应物,其起始物质的量如下表所示。甲中反应达到平衡时,测得c(H2)=0.008mol·L-1。下列判断正确的是( )
起始物质的量 | n(H2)/mol | n(I2)/mol | n(HI)/mol |
甲 | 0.02 | 0.02 | 0 |
乙 | 0.04 | 0.04 | 0 |
A. 平衡时,乙中H2的转化率是甲中的2倍
B. 平衡时,甲中混合物的颜色比乙中深
C. 平衡时,甲、乙中热量的变化值相等
D. 该温度下,反应的平衡常数K=0.25