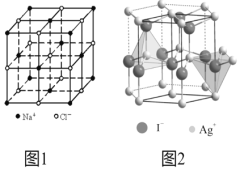
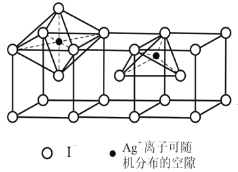
题目内容
【题目】吉林某化工厂发生爆炸,导致1个硝基苯储罐、2个苯储罐报废,导致苯酚、苯胺停产。爆炸过程还产生了大量的浓烟和强烈的刺激性气味,造成了空气污染。
(1)写出上述材料中提到的4种有机物中,任意两种有机物的结构简式①_______,②_________。
(2)爆炸过程中,产生了大量黑烟,其原因是_____________
(3)上述爆炸事故附近的江水有强烈苦杏仁气味,苯、硝基苯、二甲苯等主要污染物指标均超过国家标准。具有苦杏仁味的有机物是________,它在江水中的主要存在形式是___________。
(4)硝基苯是制造染料的重要原料,但是硝基苯进入人体,严重危害人体健康,写出实验室由苯制取硝基苯反应的化学方程式_________________。
【答案】![]()
![]() 有机物燃烧不完全 硝基苯 沉在江水底部
有机物燃烧不完全 硝基苯 沉在江水底部 ![]() +HO-NO2
+HO-NO2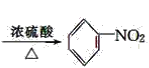 +H2O
+H2O
【解析】
(1)四种有机物为:苯、硝基苯、苯胺、苯酚;
(2)有机物中含有碳元素,如果碳元素不完全燃烧,会有黑烟生成;
(3)根据硝基苯的物理性质回答;
(4)苯和浓硝酸在浓硫酸作催化剂、加热条件下生成硝基苯和水,据此写化学方程式;
(1)四种有机物为:苯、硝基苯、苯胺、苯酚,写出任意两种的结构简式,比如苯和硝基苯的结构简式为![]() 、
、![]() ;
;
答案:![]()
![]()
(2)有机物中含有碳元素,如果碳元素不完全燃烧,会有黑烟生成,所以爆炸过程中,产生了大量黑烟,其原因是有机物不完全燃烧;
答案:有机物燃烧不完全
(3)苯、硝基苯、二甲苯中含有苦杏仁味的是硝基苯;硝基苯是有苦杏仁味的油状液体,难溶于水,密度比水大;
答案:硝基苯;沉在江水底部
(4)苯和浓硝酸在浓硫酸作催化剂、加热条件下生成硝基苯和水,反应方程式为 ![]() +HO-NO2
+HO-NO2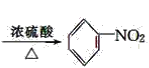 +H2O;
+H2O;
答案:(6). ![]() +HO-NO2
+HO-NO2 +H2O
+H2O

【题目】有甲、乙、丙三个体积均为2L的恒容密闭容器,按不同投料比Z[![]() 进行反应: 4HCl(g)+O2(g)
进行反应: 4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g) △H。在不同温度T条件下达到平衡时,HCl的平衡转化率与Z和T的关系如下表所示。
2Cl2(g)+2H2O(g) △H。在不同温度T条件下达到平衡时,HCl的平衡转化率与Z和T的关系如下表所示。
容器 | 起始时 | 平衡时HCl转化率 | |||
n(HCl)/mol | Z | T=100℃ | T=200℃ | T=300℃ | |
甲 | 0.8 | a | 96% | 94% | 90% |
乙 | 0.8 | b | 46% | 44% | 40% |
丙 | 0.8 | 4 | 95% | 88% | 80% |
下列说法正确的是
A.b<4
B.温度升高时,反应速率减慢,所以转化率下降
C.丙容器中,300℃平衡时,c(O2)=0.04molL-1
D.若甲容器温度在300时需要5min达到平衡,则此时间内v(Cl2)=0.036molL-1min-1
【题目】Cu、Zn及其化合物在生产、生活中有着重要作用。请回答:
(1)Cu、Zn在周期表中________区,焰色反应时Cu的4s电子会跃迁至4p轨道,写出Cu的激发态电子排布式___________。
(2)分别向CuSO4、MgSO4溶液加氨水至过量,前者为深蓝色溶液,后者为白色沉淀。
①NH3与Cu2+形成配合物的能力大于Mg2+的原因为_________________。
②溶液中的水存在H3O+、![]() 等微粒形式,
等微粒形式,![]() 可看作是H3O+与H2O通过氢键形成的离子,则
可看作是H3O+与H2O通过氢键形成的离子,则![]() 的结构式为___________。
的结构式为___________。
(3)Zn的某种化合物M是很好的补锌剂,结构式如图:

①1 mol M含有的σ键的数目为___________。
②常见含氮的配体有 H2NCH2 COOˉ、NH3、![]() 等,NH3的分子空间构型为____________,
等,NH3的分子空间构型为____________,![]() 的中心氮原子杂化方式为__________。
的中心氮原子杂化方式为__________。
③M在人体内吸收率高的原因可能是锌形成配合物后,电荷__________(填“变多”“变少”或“不变”),可在消化道内维持良好的稳定性。
(4)卤化锌的熔点如表:
卤化锌/ ZnX2 | ZnF2 | ZnCl2 | ZnBr2 |
熔点/℃ | 872 | 283 | 394 |
则ZnX2熔点如表变化的原因是____________________。
(5)Zn的某种硫化物的晶胞如图所示。已知S2-和Zn2+的半径分别为r1 pm、r2 pm,且S2-与Zn2+相切,NA为阿伏加德罗常数的值。则该晶体的密度为________g·cm-3(写计算表达式)。