题目内容
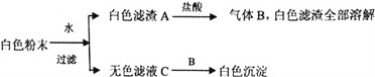
【题目】有一包白色粉末,由BaCl2、K2SO4、CaCO3、NaOH、CuSO4中的一种或几种组成,为了探究它的成份,进行了如下实验:下列判断正确的是( )
A.BaCl2、CaCO3一定存在,NaOH可能存在
B.K2SO4、CuSO4一定不存在
C.K2SO4、NaOH、CaCO3、BaCl2一定存在,K2SO4可能存在
D.C为单一溶质溶液
【答案】B
【解析】
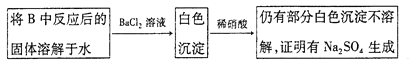
加水溶解后,溶液为无色,则一定不含有CuSO4;白色滤渣A中加盐酸后,沉淀完全溶解,则一定含有CaCO3,一定不含有BaSO4,且气体为CO2;无色滤液C中通入CO2,产生白色沉淀,说明此沉淀为BaCO3,则一定含有BaCl2、NaOH,一定不含有K2SO4。
A. BaCl2、CaCO3一定存在,如果不含有NaOH,则通入CO2后,与BaCl2不能生成沉淀,A不正确;
B.溶液无色,不存在CuSO4,因为K2SO4与BaCl2不共存,所以一定不含有K2SO4,B正确;
C. 从以上分析可知,K2SO4一定不存在,C不正确;
D. C中含有BaCl2、NaOH,不是单一溶质溶液,D不正确。
故选B。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目