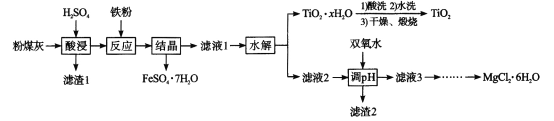
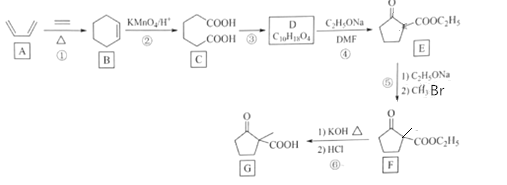
题目内容
【题目】(1)在Na2SO4和Al2(SO4)3的混合溶液中,测得Al3+浓度为0.1mol·L-1,加入等体积0.3 mol·L-1的BaCl2溶液恰好使SO42-完全沉淀,则混合溶液中Na+的浓度为____。
(2)将0.1mol·L-1的K2SO4溶液、0.2mol·L-1的Al2(SO4)3溶液和纯水混合,要使混合液中K+、Al3+、SO42-的浓度分别为0.1mol·L-1、0.1mol·L-1、0.2mol·L-1,则K2SO4溶液、Al2(SO4)3溶液、纯水三者的体积比___。(忽略体积的变化)
【答案】0.3mol·L-1 2:1:1
【解析】
(1)设混合溶液体积为1 L。n(Al3+)=c·V=0.1 mol·L-1×1 L=0.1 mol,n(SO![]() )=n(Ba2+)=0.3 mol·L-1×1 L=0.3 mol。由电荷守恒可得:3n(Al3+)+n(Na+)=2n(SO
)=n(Ba2+)=0.3 mol·L-1×1 L=0.3 mol。由电荷守恒可得:3n(Al3+)+n(Na+)=2n(SO![]() ),所以n(Na+)=2n(SO
),所以n(Na+)=2n(SO![]() )-3n(Al3+)=2×0.3 mol-3×0.1 mol=0.3 mol,c(Na+)=
)-3n(Al3+)=2×0.3 mol-3×0.1 mol=0.3 mol,c(Na+)=![]() =
=![]() =
=![]() =0.3 mol·L-1,故答案为:0.3mol·L-1;
=0.3 mol·L-1,故答案为:0.3mol·L-1;
(2)设K2SO4溶液、Al2(SO4)3溶液、纯水三者的体积分别是xL、yL、zL,则0.2x=0.1×(x+y+z)、0.4y=0.1×(x+y+z)、0.1x+0.6y=0.2×(x+y+z),解得x=2y=2z,所以K2SO4溶液、Al2(SO4)3溶液、纯水三者的体积比为2∶1∶1,故答案为:2∶1∶1。

 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案【题目】有甲、乙、丙三个体积均为2L的恒容密闭容器,按不同投料比Z[![]() 进行反应: 4HCl(g)+O2(g)
进行反应: 4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g) △H。在不同温度T条件下达到平衡时,HCl的平衡转化率与Z和T的关系如下表所示。
2Cl2(g)+2H2O(g) △H。在不同温度T条件下达到平衡时,HCl的平衡转化率与Z和T的关系如下表所示。
容器 | 起始时 | 平衡时HCl转化率 | |||
n(HCl)/mol | Z | T=100℃ | T=200℃ | T=300℃ | |
甲 | 0.8 | a | 96% | 94% | 90% |
乙 | 0.8 | b | 46% | 44% | 40% |
丙 | 0.8 | 4 | 95% | 88% | 80% |
下列说法正确的是
A.b<4
B.温度升高时,反应速率减慢,所以转化率下降
C.丙容器中,300℃平衡时,c(O2)=0.04molL-1
D.若甲容器温度在300时需要5min达到平衡,则此时间内v(Cl2)=0.036molL-1min-1