题目内容
20.下列反应的离子方程式书写正确的是( )| A. | 过氧化钠和冷水反应:Na2O2+H2O═2Na++2OH-+H2↑ | |
| B. | 铝粉投入到NaOH溶液中:2Al+2OH-═2AlO2-+H2↑ | |
| C. | 碳酸钙溶于醋酸:CaCO3+2H+═Ca2++CO2↑+H2O | |
| D. | 氯化亚铁溶液中通入氯气:2Fe2++Cl2═2Fe3++2Cl- |
分析 A.反应生成NaOH和氧气,电子不守恒;
B.漏写氧化剂水;
C.醋酸在离子反应中保留化学式;
D.反应生成氯化铁,遵循电子、电荷守恒.
解答 解:A.过氧化钠和冷水反应的离子反应为2Na2O2+2H2O═4Na++4OH-+O2↑,故A错误;
B.铝粉投入到NaOH溶液中的离子反应为2Al+2H2O+2OH-═2AlO2-+3H2↑,故B错误;
C.碳酸钙溶于醋酸的离子反应为CaCO3+2CH3COOH═2CH3COO-+Ca2++CO2↑+H2O,故C错误;
D.氯化亚铁溶液中通入氯气的离子反应为2Fe2++Cl2═2Fe3++2Cl-,故D正确;
故选D.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重氧化还原反应、复分解反应的离子反应考查,题目难度不大.

练习册系列答案
 发散思维新课堂系列答案
发散思维新课堂系列答案
相关题目
10.常温时,下列说法中正确的是( )
| A. | 0.l mol/L醋酸钙溶液中,c(Ca2+)>c(CH3COO-)>c(OH-)>c(H+) | |
| B. | 水电离出来的c(H+)=10-13mol/L的溶液中K+、Cl-、NO3-、I-一定能大量存在 | |
| C. | 往0.1mol/LCH3COOH溶液中通人少量HCl,醋酸的电离平衡向逆反应方向移动,且溶液中$\frac{c(C{H}_{3}COOH)}{c({H}^{+}).c(C{H}_{3}CO{O}^{-})}$增大 | |
| D. | 含等物质的量浓度的CH3COOH和CH3COONa混合溶液中:2c(H+)-c(CH3COO-)=2c(OH-)-c(CH3COOH) |
8.配制一定物质的量浓度的K2SO4溶液时,造成最终浓度偏低的原因可能是( )
| A. | 容量瓶事先未烘干 | B. | 定容时观察液面仰视 | ||
| C. | 定容时观察液面俯视 | D. | 定容,摇匀后有少量液体流出 |
15.下列有机物的命名及名称书写均正确的是( )
| A. | CH2BrCH2Br 二溴乙烷 | B. | CH3CH(NH2)CH2COOH 3-氨基丁酸 | ||
| C. | 硬酯酸甘油脂 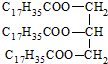 | D. | 2,2-二甲基-3-丁醇 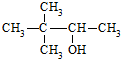 |
5.配制一定体积、一定物质的量浓度的溶液,下列情况对实验结果产生偏高影响的是( )
| A. | 定容时俯视观察液面 | |
| B. | 容量瓶中原有少量蒸馏水 | |
| C. | 溶解所用的烧杯、玻璃棒未洗涤 | |
| D. | 转移溶液时不慎将少量液体洒落在外 |
12.设NA代表阿伏加德罗常数,下列叙述正确的是( )
| A. | 标准状况下2.24 L己烷中,分子数为0.1NA | |
| B. | 22.4 L Cl2含有Cl-Cl键数为NA | |
| C. | 常温常压下16 g O2和O3混合气体中,氧原子数为NA | |
| D. | 7.8 g Na2O2与足量水反应,转移电子数为0.2NA |
10.下列过程一定需要通电才能进行的是( )
①电离 ②电镀 ③电解 ④电化学防护 ⑤电泳 ⑥电化学腐蚀.
①电离 ②电镀 ③电解 ④电化学防护 ⑤电泳 ⑥电化学腐蚀.
| A. | 全部 | B. | ②④⑤ | C. | ②③⑤ | D. | ②③④⑥ |
 如图是某学校实验室从化学试剂商店买回的浓盐酸试剂标签上的部分内容.现用该浓盐酸配制250mL 2mol•L-1的稀盐 酸.可供选用的仪器有:①胶头滴管;②烧瓶;③烧杯;④药匙; ⑤量筒;⑥托盘天平;⑦玻璃棒.请回答下列问题:
如图是某学校实验室从化学试剂商店买回的浓盐酸试剂标签上的部分内容.现用该浓盐酸配制250mL 2mol•L-1的稀盐 酸.可供选用的仪器有:①胶头滴管;②烧瓶;③烧杯;④药匙; ⑤量筒;⑥托盘天平;⑦玻璃棒.请回答下列问题: