题目内容
8.配制一定物质的量浓度的K2SO4溶液时,造成最终浓度偏低的原因可能是( )| A. | 容量瓶事先未烘干 | B. | 定容时观察液面仰视 | ||
| C. | 定容时观察液面俯视 | D. | 定容,摇匀后有少量液体流出 |
分析 根据c=$\frac{n}{V}$并结合溶质的物质的量n和溶液的体积V的变化来进行误差分析.
解答 解:A、若容量瓶未干燥即用来配制溶液,对溶液浓度无影响,因为只要定容时正确,至于水是原来就有的还是后来加入的,对浓度无影响,故A错误;
B、定容时仰视液面,会导致溶液体积偏大,则浓度偏小,故B正确;
C、定容时俯视液面,会导致溶液体积偏小,则浓度偏大,故C错误;
D、定容、摇匀后,溶液是均一稳定的,有溶液流出对浓度无影响,故D错误.
故选B.
点评 本题考查了一定物质的量浓度溶液的配制过程中的误差分析,属于基础型题目,难度不大,理解是解题的关键.

练习册系列答案
相关题目
18.下列元素中,原子半径最小的是( )
| A. | Cl | B. | S | C. | P | D. | Si |
19.设NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 5.6 g Fe 和足量的HCl完全反应失去电子数为0.3 NA | |
| B. | 22.4L O2含有NA个O2分子 | |
| C. | 0.2 mol/L CaCl2溶液中含有Clˉ离子的数目为0.4NA | |
| D. | 1.6g CH4所含的电子数为NA |
16.下列操作或事实正确的是( )
| A. | 常温下,用pH试纸测得某新制氯水的pH值为9 | |
| B. | 用标准盐酸溶液滴定一定体积的待测NaOH溶液时,用石蕊做指示剂 | |
| C. | 用碱式滴定管量取高锰酸钾溶液5.10 mL | |
| D. | 用10 mL的量筒量取8.5 mL浓硫酸 |
20.下列反应的离子方程式书写正确的是( )
| A. | 过氧化钠和冷水反应:Na2O2+H2O═2Na++2OH-+H2↑ | |
| B. | 铝粉投入到NaOH溶液中:2Al+2OH-═2AlO2-+H2↑ | |
| C. | 碳酸钙溶于醋酸:CaCO3+2H+═Ca2++CO2↑+H2O | |
| D. | 氯化亚铁溶液中通入氯气:2Fe2++Cl2═2Fe3++2Cl- |
18.下列物质属于强电解质且能导电的是( )
①氯化钠溶液 ②氯化铵固体 ③铜 ④BaSO4 ⑤熔融NaOH ⑥稀硫酸 ⑦乙酸.
①氯化钠溶液 ②氯化铵固体 ③铜 ④BaSO4 ⑤熔融NaOH ⑥稀硫酸 ⑦乙酸.
| A. | ①②⑤⑥ | B. | ⑤ | C. | ②⑤ | D. | ①③④⑤⑥ |
 吸收尾气中未反应的氯气和防止空气中水蒸气进入装置D.
吸收尾气中未反应的氯气和防止空气中水蒸气进入装置D.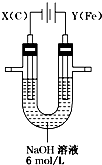 高铁酸钾(K2FeO4)具有高效的消毒作用,为一种新型非氯高效消毒剂.电解法制备高铁酸钾操作简便,产率高,易于实验室制备.其原理如图所示,其总电解反应为:
高铁酸钾(K2FeO4)具有高效的消毒作用,为一种新型非氯高效消毒剂.电解法制备高铁酸钾操作简便,产率高,易于实验室制备.其原理如图所示,其总电解反应为: .在工业上,用氯化钠为原料,在碱性溶液中,通过电解的方法可制得NaClO,用离子方程式表示制取NaClO的电解总反应:Cl-+H2O$\frac{\underline{\;通电\;}}{\;}$ClO-+H2↑.将等浓度等体积的NaClO与Na2SO3溶液混合后,两者恰好完全反应,写出混合过程的离子反应方程式ClO-+SO32-=Cl-+SO42-.
.在工业上,用氯化钠为原料,在碱性溶液中,通过电解的方法可制得NaClO,用离子方程式表示制取NaClO的电解总反应:Cl-+H2O$\frac{\underline{\;通电\;}}{\;}$ClO-+H2↑.将等浓度等体积的NaClO与Na2SO3溶液混合后,两者恰好完全反应,写出混合过程的离子反应方程式ClO-+SO32-=Cl-+SO42-.