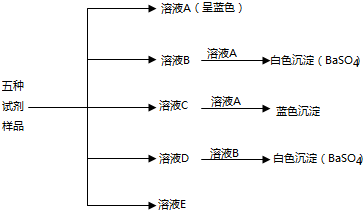
题目内容
12.设NA代表阿伏加德罗常数,下列叙述正确的是( )| A. | 标准状况下2.24 L己烷中,分子数为0.1NA | |
| B. | 22.4 L Cl2含有Cl-Cl键数为NA | |
| C. | 常温常压下16 g O2和O3混合气体中,氧原子数为NA | |
| D. | 7.8 g Na2O2与足量水反应,转移电子数为0.2NA |
分析 A、标况下,己烷为液态;
B、氯气所处的状态不明确;
C、O2和O3均由氧原子构成;
D、Na2O2与足量水的反应为歧化反应.
解答 解:A、标况下,己烷为液态,故不能根据气体摩尔体积来计算其物质的量和分子个数,故A错误;
B、氯气所处的状态不明确,故气体摩尔体积的数值无从得知,故物质的量无法计算,故B错误;
C、O2和O3均由氧原子构成,则16g混合物中含有的氧原子的物质的量n=$\frac{16g}{16g/mol}$=1mol,即NA个,故C正确;
D、7.8g过氧化钠的物质的量为0.1mol,而Na2O2与足量水的反应为歧化反应,1mol过氧化钠转移1mol电子,故0.1mol过氧化钠转移0.1mol电子即0.1NA个,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
20.下列反应的离子方程式书写正确的是( )
| A. | 过氧化钠和冷水反应:Na2O2+H2O═2Na++2OH-+H2↑ | |
| B. | 铝粉投入到NaOH溶液中:2Al+2OH-═2AlO2-+H2↑ | |
| C. | 碳酸钙溶于醋酸:CaCO3+2H+═Ca2++CO2↑+H2O | |
| D. | 氯化亚铁溶液中通入氯气:2Fe2++Cl2═2Fe3++2Cl- |
7.下列变化必须加入氧化剂才能完成的是( )
| A. | MnO4-→MnO2 | B. | Cl2→HClO | C. | Fe2+→Fe3+ | D. | HCO3-→CO${\;}_{3}^{2-}$ |
4.对于可逆反应C(s)+H2O(g)?CO(g)+H2(g),下列说法不能证明反应已达平衡状态的是( )
| A. | 绝热容器,温度不再改变 | |
| B. | 恒容时,压强不在改变 | |
| C. | 恒压时,体积不在改变 | |
| D. | 断裂2 mol O-H键同时形成1molH-H键 |

 ;
;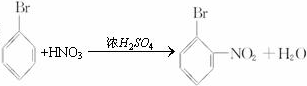 ;
; 、
、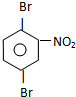 .
. 吸收尾气中未反应的氯气和防止空气中水蒸气进入装置D.
吸收尾气中未反应的氯气和防止空气中水蒸气进入装置D. .在工业上,用氯化钠为原料,在碱性溶液中,通过电解的方法可制得NaClO,用离子方程式表示制取NaClO的电解总反应:Cl-+H2O$\frac{\underline{\;通电\;}}{\;}$ClO-+H2↑.将等浓度等体积的NaClO与Na2SO3溶液混合后,两者恰好完全反应,写出混合过程的离子反应方程式ClO-+SO32-=Cl-+SO42-.
.在工业上,用氯化钠为原料,在碱性溶液中,通过电解的方法可制得NaClO,用离子方程式表示制取NaClO的电解总反应:Cl-+H2O$\frac{\underline{\;通电\;}}{\;}$ClO-+H2↑.将等浓度等体积的NaClO与Na2SO3溶液混合后,两者恰好完全反应,写出混合过程的离子反应方程式ClO-+SO32-=Cl-+SO42-.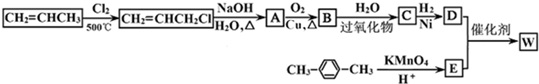
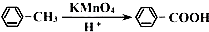
 .
.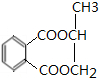 .
.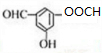 .
.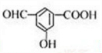 .
.