题目内容
9. 如图是某学校实验室从化学试剂商店买回的浓盐酸试剂标签上的部分内容.现用该浓盐酸配制250mL 2mol•L-1的稀盐 酸.可供选用的仪器有:①胶头滴管;②烧瓶;③烧杯;④药匙; ⑤量筒;⑥托盘天平;⑦玻璃棒.请回答下列问题:
如图是某学校实验室从化学试剂商店买回的浓盐酸试剂标签上的部分内容.现用该浓盐酸配制250mL 2mol•L-1的稀盐 酸.可供选用的仪器有:①胶头滴管;②烧瓶;③烧杯;④药匙; ⑤量筒;⑥托盘天平;⑦玻璃棒.请回答下列问题:(1)配制稀盐酸时,还缺少的仪器有250mL容量瓶(写出仪器名 称及规格);
(2)经计算,配制250mL 2mol•L-1的稀盐酸需要用量筒量取上述浓盐酸的体积
为42.4mL,量取盐酸时应选用50mL(选填10、50、100)规格的量筒;
(3)对所配制的稀盐酸进行测定,发现其浓度小于2mol•L-1,引起误差的原因可能是AD.
A.转移溶液后,未洗涤烧杯和玻璃棒
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.定容时俯视容量瓶刻度线
D.定容摇匀后发现液面低于容量瓶的刻度线,再加水至刻度线.
分析 (1)配制250mL 2mol•L-1的稀盐酸需要的仪器有:量筒、烧杯、玻璃棒、100mL容量瓶、胶头滴管,据此解答;
(2)根据c=$\frac{1000ρω}{M}$计算浓盐酸的物质的量浓度,根据稀释定律,稀释前后溶质硫酸的物质的量不变,据此计算需要浓盐酸的体积;
根据浓盐酸的体积选择量筒的规格;
(3)分析操作对溶质物质的量、溶液体积的影响,根据c=$\frac{n}{V}$判断对溶液浓度的影响.
解答 解:(1)配制250mL 2mol•L-1的稀盐酸需要的仪器有:量筒、烧杯、玻璃棒、250mL容量瓶、胶头滴管,故还缺少250mL容量瓶,
故答案为:250mL容量瓶;
(2)该浓盐酸的物质的量浓度为$\frac{1000×1.18×36.5%}{36.5}$mol/L=11.8mol/L,根据稀释定律,稀释前后溶质硫酸的物质的量不变,令需要钠元素的体积为V,则:
250mL×2mol/L=V×11.8mol/L
解得:V=42.4mL
故选择50mL的量筒,
故答案为:42.4,50;
(3)A.转移溶液后,未洗涤烧杯和玻璃棒,少量HCl沾在烧杯内壁和玻璃棒上,移入容量瓶中HCl的物质的量偏小,所配溶液浓度偏小,故A符合;
B.配制需加水定容,容量瓶在使用前未干燥,里面有少量蒸馏水,对所配溶液浓度无影响,故B不符合;
C.定容时俯视容量瓶刻度线,液面在刻度线以下,溶液的体积偏小,所配溶液的浓度偏大,故C不符合;
D.定容摇匀后发现液面低于容量瓶的刻度线,少量溶液残留在瓶塞与瓶口之间,再加水至刻度线,溶液体积偏大,所配溶液浓度偏小,故D符合;
故选AD.
点评 考查一定物质的量浓度溶液的配制、过量计算等,难度中等,注意过量计算的格式,根据c=$\frac{n}{V}$理解误差分析原理.

| A. | 5.6 g Fe 和足量的HCl完全反应失去电子数为0.3 NA | |
| B. | 22.4L O2含有NA个O2分子 | |
| C. | 0.2 mol/L CaCl2溶液中含有Clˉ离子的数目为0.4NA | |
| D. | 1.6g CH4所含的电子数为NA |
| A. | 过氧化钠和冷水反应:Na2O2+H2O═2Na++2OH-+H2↑ | |
| B. | 铝粉投入到NaOH溶液中:2Al+2OH-═2AlO2-+H2↑ | |
| C. | 碳酸钙溶于醋酸:CaCO3+2H+═Ca2++CO2↑+H2O | |
| D. | 氯化亚铁溶液中通入氯气:2Fe2++Cl2═2Fe3++2Cl- |
| A. | 绝热容器,温度不再改变 | |
| B. | 恒容时,压强不在改变 | |
| C. | 恒压时,体积不在改变 | |
| D. | 断裂2 mol O-H键同时形成1molH-H键 |
| A. | 人类目前所直接利用的能量大部分是由化学反应产生的 | |
| B. | 化学变化中的能量变化主要是由化学键变化引起的 | |
| C. | 化学反应中能量变化的大小与反应物的质量多少无关 | |
| D. | 能量变化是化学反应的基本特征之一 |
①氯化钠溶液 ②氯化铵固体 ③铜 ④BaSO4 ⑤熔融NaOH ⑥稀硫酸 ⑦乙酸.
| A. | ①②⑤⑥ | B. | ⑤ | C. | ②⑤ | D. | ①③④⑤⑥ |
 .在工业上,用氯化钠为原料,在碱性溶液中,通过电解的方法可制得NaClO,用离子方程式表示制取NaClO的电解总反应:Cl-+H2O$\frac{\underline{\;通电\;}}{\;}$ClO-+H2↑.将等浓度等体积的NaClO与Na2SO3溶液混合后,两者恰好完全反应,写出混合过程的离子反应方程式ClO-+SO32-=Cl-+SO42-.
.在工业上,用氯化钠为原料,在碱性溶液中,通过电解的方法可制得NaClO,用离子方程式表示制取NaClO的电解总反应:Cl-+H2O$\frac{\underline{\;通电\;}}{\;}$ClO-+H2↑.将等浓度等体积的NaClO与Na2SO3溶液混合后,两者恰好完全反应,写出混合过程的离子反应方程式ClO-+SO32-=Cl-+SO42-.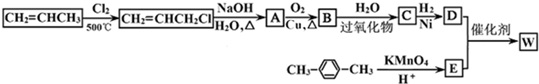
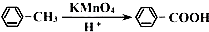
 .
.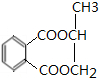 .
.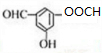 .
. .
.