题目内容
【题目】已知NA是阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,7.8g乙炔和苯的混合物中含C—H键数目为0.6NA
B.10g46%的乙醇溶液中,含H—O键的数目为0.1NA
C.1L0.1mol·L1 FeCl3溶液中含Fe3+数目为0.1NA
D.将1molNH3通入足量水中,NH3 ·H2O、NH4+ 粒子数目之和为NA
【答案】A
【解析】
A项、乙炔和苯的最简式相同,均为CH,依据最简式可知7.8gCH的物质的量为![]() =0.6mol,0.6molCH含C—H键数目为0.6NA,故A正确;
=0.6mol,0.6molCH含C—H键数目为0.6NA,故A正确;
B项、乙醇溶液中乙醇和水均含有H—O键,则10g46%的乙醇溶液中含H—O键的数目大于0.1NA,故B错误;
C项、FeCl3是强酸弱碱盐,Fe3+在溶液中水解,则1L0.1mol·L1 FeCl3溶液中含Fe3+数目小于0.1NA,故C错误;
D项、由物料守恒可知,将1molNH3通入足量水中,NH3 ·H2O、NH4+ 和NH3粒子数目之和为NA,故D错误;
故选A。

 一诺书业暑假作业快乐假期云南美术出版社系列答案
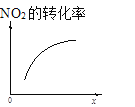
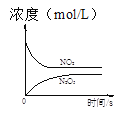
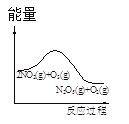
一诺书业暑假作业快乐假期云南美术出版社系列答案【题目】臭氧是理想的烟气脱硝试剂,其脱硝反应为:2NO2(g)+O3(g)N2O5(g)+O2(g),若反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是
A | B | C | D |
|
|
|
|
t1时仅加入催化剂,平衡向正方向移动 | 达平衡时,仅改变x,则x为c(O2) | 从反应开始达平衡气体浓度变化 | 升高温度,平衡常数减小 |
A.AB.BC.CD.D
【题目】在100℃时,将0.40 mol二氧化氮气体充入一个2 L抽空的密闭容器中,发生反应:2NO2 N2O4。每隔一段时间就对该容器内的物质进行分析,得到下表数据:
时间/s | 0 | 20 | 40 | 60 | 80 |
n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
(1)在上述条件下,从反应开始至20 s时,用NO2表示的平均反应速率为__________mol·L1·s1。
(2)n3________(填“>”“<”或“=”)n4;该反应的平衡常数K的数值为___________(精确到0.1)。
(3)若在相同条件下最初向该容器中充入N2O4,要达到上述平衡状态,N2O4的起始浓度是______mol·L1。
(4)上述(3)达到平衡后N2O4的转化率为______________,混合气体的平均摩尔质量为______________。
(5)达到平衡后,如果升高温度,气体颜色会变深,则升高温度后,反应2NO2N2O4的平衡常数将_______________(填“增大”“减小”或“不变”)。
(6)达到平衡后,如果向该密闭容器中再充入0.32 mol He,并把容器体积扩大为4 L,则平衡将______________(填“向左移动”“向右移动”或“不移动”)。