题目内容
【题目】臭氧是理想的烟气脱硝试剂,其脱硝反应为:2NO2(g)+O3(g)N2O5(g)+O2(g),若反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是
A | B | C | D |
|
|
|
|
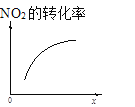
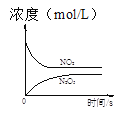
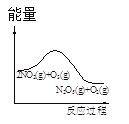
t1时仅加入催化剂,平衡向正方向移动 | 达平衡时,仅改变x,则x为c(O2) | 从反应开始达平衡气体浓度变化 | 升高温度,平衡常数减小 |
A.AB.BC.CD.D
【答案】CD
【解析】
A.t1时刻,改变条件,反应速率加快,平衡不移动,该反应前后气体的物质的量减小,不可能是增大压强,应是使用催化剂,但催化剂不影响平衡的移动,A错误;
B.达平衡时,仅增大c(O2),平衡向逆反应方向移动,NO2转化率降低,由图可知,NO2的转化率随x增大而增大,x可以代表O3浓度或压强,B错误;
C.反应2NO2(g)+O3(g)N2O5(g)+O2(g)从开始的NO2浓度减小,N2O5浓度增大,到达平衡时浓度都不变,C正确;
D.由图可知,反应物总能量高于生成物总能量,正反应为放热反应,升高温度平衡向逆反应方向移动,平衡常数减小,D正确;
答案选CD。

【题目】合理处理燃气中的H2S,不仅可减少对大气的污染,还可进行资源化利用。回答下列问题:
(1)H2S和S的燃烧热如表所示,
物质 | 燃烧热/△H(kJmol-1) |
H2S | -a |
S | -b |
请写出常温下H2S与SO2反应的热化学方程式______。
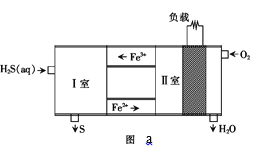
(2)可以把H2S设计为一种燃料电池,原理如图a所示:其中,Fe2+在电池工作中的作用是______;请写出 I室发生的离子方程式______。
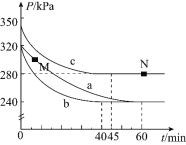
(3)为探究H2S的直接热解2H2S(g)=2H2(g )+S2(g)。在一体积为2L的密闭容器中充入2 mol H2S与1 molAr (起到稀释作用),进行实验。
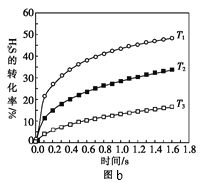
①某同学测出不同温度下H2S的物质的量与反应时间的图象,图b是截取该图象的中间某部分。请计算T2温度下,0-l0s内,H2S的反应速率v=______moL-1s-1;
②图b中,T1、T2、T3三个温度,最高的是______;比较A点与B点的逆反应速率的大小,vA(逆)______vB(逆)(填“>”、“<”或“=”);
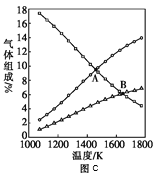
③图c是表示反应2H2S(g)=2H2(g)+S2(g)平衡时,装置内各组分气体物质的量分数=与温度的关系(其中Ar气体变化曲线未画出)。请计算:C点的平衡常数K=______;D点平衡时,H2S的转化率=______。