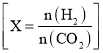题目内容
【题目】下列说法正确的是( )
A.向0.1 mol·L-1氨水中加入少量水,pH减小,![]() 减小
减小
B.同浓度的下列溶液中,① NH4HSO4 ②NH4Cl ③NH3·H2O ④CH3COONH4 ⑤NH4ClO,c(NH4+)由大到小的顺序是:①>②>④>⑤>③
C.0.1 mol·L-1 Na2CO3溶液中:c(HCO3-)=2c(H2CO3)+c(H+)-c(OH-)
D.常温下,浓度均为0.1 mol·L-1L NaA和HA溶液中pH=9,则c (HA)>c(A-)>c(Na+)>c(OH-)>c(H+)
【答案】B
【解析】
A.向0.1 mol·L-1氨水中加入少量水,促进一水合氨的电离,但溶质离子浓度降低,即c(OH-)和c(NH4+)减小,则pH减小;又Ka不变,则![]() =
=![]() 会增大,故A 错误;
会增大,故A 错误;
B. ①②④和⑤是强电解质,完全电离,③是弱电解质部分电离,所以上述溶液中c(NH4+)③最小;①中氢离子抑制酸根离子水解, ④和⑤中阴离子促进铵根离子的水解,且促进作用:⑤>④,因铵根离子个数相同的铵盐中,水解程度越小,c(NH4+)越大,所以同浓度的上述溶液中,c(NH4+)由大到小的顺序是:①>②>④>⑤>③,故B正确;
C. 0.1 mol·L-1 Na2CO3溶液中遵循质子守恒,即c(HCO3-)+2c(H2CO3)+c(H+)=c(OH-),即c(HCO3-)=c(OH-) - 2c(H2CO3)+c(H+),故C错误;
D. 常温下混合溶液的pH=9,溶液呈碱性,说明NaA水解程度大于HA电离程度,钠离子不水解,因水溶液中离子的水解和弱电解质的电离程度都较小,所以存在c(HA)>c(Na+)>c(A)>c(OH)>c(H+),故D错误;
故选:B。

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目