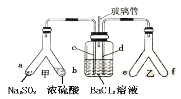
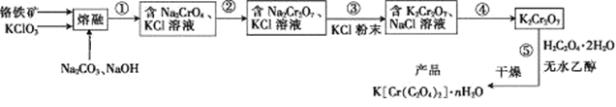
题目内容
【题目】海洋资源的利用具有广阔前景。
(1)海水淡化的方法有_____(选填一种即可)。
(2)从海水中提取溴的主要步骤是向浓缩的海水中通入氯气,将溴离子氧化,该反应的离子方程式是____。
(3)下图是从海水中提取镁的简单流程。
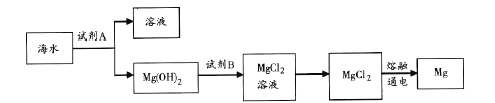
工业上常用于沉淀Mg2+的试剂A 的俗名是___,Mg(OH)2转化为MgCl2 的离子方程式是_______。
(4)海带灰中富含以I-形式存在的碘元素。实验室提取I2 的途径如下所示:
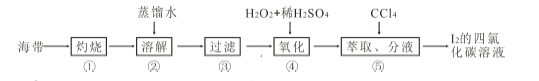
①灼烧海带至灰烬时所用的主要仪器名称是_______。步骤②加热煮沸一会的目的是______________。
② 步骤④向滤液中加H2O2 和稀H2SO4 溶液,写出该反应的离子方程式_______________。反应结束后,再加入CCl4 作萃取剂,振荡、静置,可以观察到CCl4 层呈____________色。
【答案】蒸馏法、电渗析法、离子交换法(选填一种即可) Cl2 + 2Br- = Br2 + Cl- 熟石灰或石灰乳 Mg(OH)2 + 2H+ = Mg2+ + 2H2O 坩埚 促使海带灰中含碘物质快速充分溶解 2I- + H2O2 + 2H+ = I2 + 2H2O 紫或紫红
【解析】
(1)淡水利用蒸馏原理来得到;
(2)氯气能氧化溴离子得到氯离子和单质溴;
(3)由流程可知,海水晒盐后分离出母液含镁离子,加试剂A为石灰乳(或生石灰/氧化钙),生成氢氧化镁沉淀,再与盐酸反应生成氯化镁,冷却结晶分离出晶体,在HCl气流中脱水,最后电解熔融氯化镁冶炼Mg;
(4)①灼烧固体时所用的主要仪器名称是坩埚,步骤②加热煮沸一会是促进含碘物质充分溶解;
②氢离子和过氧化氢将碘离子氧化为单质碘;碘的CCl4溶液呈紫色。
(1)把海水用蒸馏等方法可以得到淡水;
(2)氯气能氧化溴离子得到氯离子和单质溴,反应的离子方程式为2Br-+Cl2═Br2+2Cl-;
(3)工业上常用于沉淀Mg2+的试剂A是熟石灰Ca(OH)2,便于易得,Mg(OH)2转化为MgCl2的离子方程式为:Mg(OH)2+2H+=Mg2++2H2O;
(4)①灼烧固体时所用的主要仪器名称是坩埚,步骤②加热煮沸一会的目的是:促使海带灰中含碘物质快速充分溶解;
②加入氢离子和过氧化氢起的作用为氧化剂,将碘离子转化为单质碘,离子方程式为2H++2I-+H2O2═I2+2H2O,反应结束后,再加入CCl4作萃取剂,振荡、静置,可以观察到CCl4层呈紫或紫红色。

 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案【题目】下列实验现象与实验操作不相匹配的是
实验操作 | 实验现象 | |
A | 向盛有高锰酸钾酸性溶液的试管中通入足量的乙烯后静置 | 溶液的紫色逐渐褪去,静置后溶液分层 |
B | 将镁条点燃后迅速伸入集满CO2的集气瓶 | 集气瓶中产生浓烟并有黑色颗粒产生 |
C | 向盛有饱和硫代硫酸钠溶液的试管中滴加稀盐酸 | 有刺激性气味气体产生,溶液变浑浊 |
D | 向盛有FeCl3溶液的试管中加过量铁粉,充分振荡后加1滴KSCN溶液 | 黄色逐渐消失,加KSCN后溶液颜色不变 |
A. AB. BC. CD. D