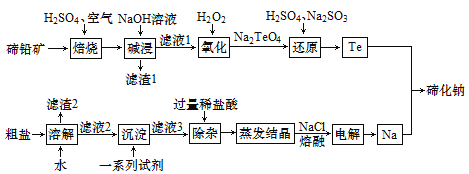
题目内容
【题目】将m克Fe2O3、Al2O3样品溶解在过量的200mL0.1mol·L-1的硫酸溶液中,然后向其中加入NaOH溶液使Fe3+、Al3+刚好完全沉淀,用去NaOH溶液100mL,则NaOH溶液的浓度为( )
A.0.1mol·L-1B.0.2mol·L-1C.0.4mol·L-1D.0.8mol·L-1
【答案】C
【解析】
反应生成硫酸铝、硫酸铁,硫酸可能有剩余,向反应后的混合溶液中加入100mLNaOH溶液,恰好使Fe3+、Al3+完全沉淀,此时溶液中溶质为Na2SO4,根据钠离子守恒有n(NaOH)=2n(Na2SO4),根据硫酸根守恒有n(Na2SO4)=n(H2SO4),据此计算n(NaOH),再根据c=![]() 计算NaOH溶液的浓度。
计算NaOH溶液的浓度。
将a克Al2O3和Fe2O3样品溶解在过量的100ml浓度为0.10mol/L的硫酸溶液中,反应生成硫酸铝、硫酸铁,硫酸可能有剩余,向反应后的混合溶液中加入100mL NaOH溶液,恰好使Fe3+、Al3+完全沉淀,此时溶液中溶质为Na2SO4,根据硫酸根守恒有n(Na2SO4)=n(H2SO4)=0.2L×0.1mol/L=0.02mol,根据钠离子守恒有:n(NaOH)=2n(Na2SO4)=0.04mol,则该氢氧化钠溶液的浓度为:c(NaOH)=![]() =0.4mol/L。
=0.4mol/L。
答案选C。

【题目】H2S在金属离子的鉴定分析、煤化工等领域都有重要应用。请回答:
Ⅰ.工业上一种制备H2S的方法是在催化剂、高温条件下,用天然气与SO2反应,同时生成两种能参与大气循环的氧化物。
(1)该反应的化学方程式为_____________。
Ⅱ.H2S可用于检测和沉淀金属阳离子。
(2)H2S的第一步电离方程式为________。
(3)已知:25 ℃时,Ksp(SnS)=1.0×10-25,Ksp(CdS)=8.0×10-27。该温度下,向浓度均为0.1 mol·L-1的CdCl2和SnCl2的混合溶液中通入H2S,当Sn2+开始沉淀时,溶液中c(Cd2+)=________(溶液体积变化忽略不计)。
Ⅲ.H2S是煤化工原料气脱硫过程的重要中间体。反应原理为
ⅰ.COS(g)+H2(g) ![]() H2S(g)+CO(g) ΔH=+7 kJ·mol-1;
H2S(g)+CO(g) ΔH=+7 kJ·mol-1;
ⅱ.CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH=-42 kJ·mol-1。
CO2(g)+H2(g) ΔH=-42 kJ·mol-1。
(4)已知:断裂1 mol分子中的化学键所需吸收的能量如表所示。
分子 | COS(g) | H2(g) | CO(g) | H2S(g) | H2O(g) | CO2(g) |
能量/(kJ·mol-1) | 1 319 | 442 | x | 678 | 930 | 1 606 |
表中x=________。
(5)向10 L容积不变的密闭容器中充入1 mol COS(g)、1 mol H2(g)和1 mol H2O(g),进行上述两个反应。其他条件不变时,体系内CO的平衡体积分数与温度(T)的关系如图所示。
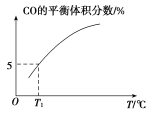
①随着温度升高,CO的平衡体积分数_____(填“增大”或“减小”)。原因为_______
②T1℃时,测得平衡时体系中COS的物质的量为0.80 mol。则该温度下,COS的平衡转化率为_____;反应ⅰ的平衡常数为_____(保留两位有效数字)。