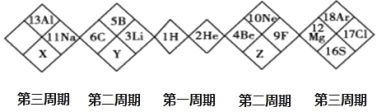
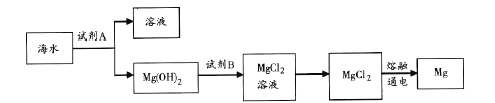
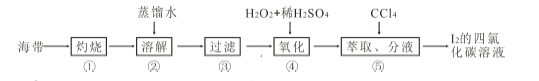
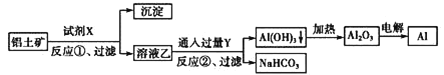
题目内容
【题目】设阿伏加德罗常数的值为NA。下列说法正确的是
A.12g金刚石中含有的共价键数目为4NA
B.3.2gCu与足量浓硝酸反应生成的气体分子数为0.1NA
C.标准状况下,2.24LCH3OH中含有的电子数为1.8NA
D.常温常压下,4.4gN2O和CO2的混合气体中含有0.3NA个原子
【答案】D
【解析】
A.12g金刚石中含有的C原子的物质的量是1mol,由于金刚石中C原子与相邻的4个C原子形成共价键,每个共价键为相邻的两个C原子所共有,所以1molC原子形成的共价键为4mol×![]() =2mol,含有的共价键数目为2NA,A错误;
=2mol,含有的共价键数目为2NA,A错误;
B.3.2gCu的物质的量是0.05mol,根据Cu与浓硝酸反应方程式:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O可知:0.05molCu与足量浓硝酸反应,转移0.1mol电子,能够产生0.1molNO2,由于NO2与N2O4存在转化平衡,所以反应生成的气体分子的物质的量小于0.1mol,气体分子数小于0.1NA,B错误;
C.在标准状况下CH3OH是液态物质,不能使用气体摩尔体积计算,C错误;
D. N2O和CO2的相对分子质量都是44,二者分子中都含有3个原子,所以常温常压下,4.4gN2O和CO2的混合气体中气体分子的物质的量是0.1mol,其中含有0.3NA个原子,D正确;
故合理选项是D。

练习册系列答案
 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案
相关题目