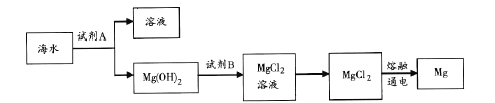
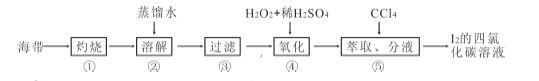
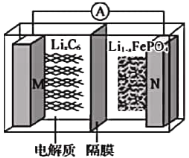
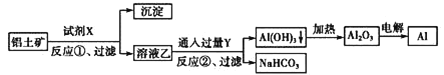
题目内容
【题目】下列反应的离子方程式书写正确的是( )
A.实验室用浓盐酸与MnO2反应制Cl2:MnO2+2H++2Cl-![]() Cl2↑+Mn2++H2O
Cl2↑+Mn2++H2O
B.稀硫酸与NaOH溶液反应:2H++2OH-=2H2O
C.醋酸洗涤铜器表面的碱式碳酸铜:Cu2(OH) 2CO3+4H+=2Cu2++CO2↑+3H2O
D.向沸腾的蒸馏水中滴加饱和FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O![]() Fe(OH) 3(胶体)+3H+
Fe(OH) 3(胶体)+3H+
【答案】D
【解析】
A选项中电荷不守恒;B项没有化为最简整数比;C项醋酸是弱酸。
A、实验室用浓盐酸与MnO2反应制Cl2:MnO2+4H++2Cl-![]() Cl2↑+Mn2++2H2O,故A错误;
Cl2↑+Mn2++2H2O,故A错误;
B、 稀硫酸与NaOH溶液反应:H++OH-=H2O,故B错误;
C、醋酸是弱酸,要保留化学式,故C错误;
D、向沸腾的蒸馏水中滴加饱和FeCl3溶液制备Fe(OH)3胶体,反应的离子方程式为:Fe3++3H2O![]() Fe(OH) 3(胶体)+3H+,故D正确。
Fe(OH) 3(胶体)+3H+,故D正确。
答案选D。

练习册系列答案
相关题目
【题目】下列实验操作能达到相应实验目的的是
选项 | 实验目的 | 实验操作 |
A | 探究I-与Fe2+的还原性强弱 | 向FeCl3稀溶液中依次加入KI溶液、淀粉 |
B | 探究HPO42-在水溶液中的电离程度与水解程度的相对大小 | 测定0.1 mol·L-1NaH2PO4溶液的pH |
C | 配制0.1 mol·L-1邻苯二甲酸氢钾( | 称取5.1 g邻苯二甲酸氢钾于烧杯中,加入少量蒸馏水溶解,转移至500 mL容量瓶中定容 |
D | 比较CaCO3和CaSO4的Ksp大小 | 向澄清石灰水中滴入0.1 mol·L-1Na2CO3溶液至不再有沉淀产生,再滴加0.1 mol·L-1Na2SO4溶液 |
A.AB.BC.CD.D