题目内容
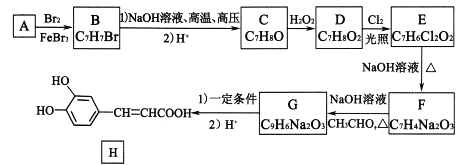
【题目】A~I分别表示中学化学中常见的一种物质,其中A、I为常见金属,它们之间的相互关系如图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、D、E、F六种物质中均含同一种元素。请填写下列空白:

(1)A、B、C、D、E、F六种物质中所含同一种元素在周期表中的位置是________。
(2)写出C物质的化学式:________。
(3)写出①、⑥反应的化学方程式:
①:____________________________。
⑥:____________________________。
(4)从能量变化的角度看,反应①②③中,属于放热反应的是________(填序号)。
【答案】第四周期 第Ⅷ族 FeCl2 3Fe3O4+8Al![]() 9Fe+4Al2O3 4Fe(OH)2+O2+2H2O= 4Fe(OH)3 ①②
9Fe+4Al2O3 4Fe(OH)2+O2+2H2O= 4Fe(OH)3 ①②
【解析】
G为主族元素的固态氧化物,可以和氢氧化钠反应,判断为两性氧化物,应为Al2O3,与NaOH反应生成NaAlO2,则J为NaAlO2,电解生成O2和Al,又A、I为常见金属,由反应④可知,I为Al,则H为O2,F为红褐色沉淀,则应为Fe(OH)3,则D为FeCl3,E为Fe(OH)2,C为FeCl2,所以B为Fe3O4,与Al在高温下发生铝热反应生成A,A为Fe,根据物质的性质可进一步书写有关反应的化学方程式,据此分析作答。
根据上述分析可知,A、B、C、D、E、F、G、H、I和J分别是Fe、 Fe3O4、 FeCl2、 FeCl3、 Fe(OH)2、Fe(OH)3、O2、Al和NaAlO2,则
(1)A、B、C、D、E、F六种物质中所含同一种元素为Fe,在元素周期表中的位置为:第四周期 第Ⅷ族;
(2)C为FeCl2;
(3)反应①是Fe3O4与Al高温下制备Fe的过程,其化学方程式为:3Fe3O4+8Al![]() 9Fe+4Al2O3;反应⑥是Fe(OH)2转化为Fe(OH)3的过程,其化学方程式为4Fe(OH)2+O2+2H2O= 4Fe(OH)3,故答案为:3Fe3O4+8Al
9Fe+4Al2O3;反应⑥是Fe(OH)2转化为Fe(OH)3的过程,其化学方程式为4Fe(OH)2+O2+2H2O= 4Fe(OH)3,故答案为:3Fe3O4+8Al![]() 9Fe+4Al2O3;4Fe(OH)2+O2+2H2O= 4Fe(OH)3;
9Fe+4Al2O3;4Fe(OH)2+O2+2H2O= 4Fe(OH)3;
(4)反应①铝热反应属于放热反应,反应②Fe的燃烧反应属于放热反应,反应③电解熔融氧化铝为吸热反应,则属于放热反应的是:①②。

【题目】某兴趣小组以废铁屑制得硫酸亚铁铵后,按下列流程制备二水合草酸亚铁(FeC2O4·2H2O),进一步制备高纯度还原铁粉。

已知:FeC2O4·2H2O难溶于水,150℃开始失结晶水;H2C2O4易溶于水,溶解度随温度升高而增大。
请回答:
(1)下列操作或描述正确的是__________。
A.步骤②,H2C2O4稍过量主要是为了抑制Fe2+水解
B.步骤③,采用热水洗涤可提高除杂效果
C.步骤③,母液中的溶质主要是(NH4)2SO4 和H2C2O4
D.步骤③,如果在常压下快速干燥,温度可选择略高于100℃
(2)如图装置,经过一系列操作完成步骤③中的抽滤和洗涤。请选择合适的编号,按正确的操作顺序补充完整(洗涤操作只需考虑一次):
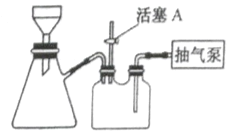
开抽气泵→a→b→d→_________→c→关抽气泵
a.转移固液混合物; b.关活塞A; c.开活塞A; d.确认抽干; e.加洗涤剂洗涤。
(3)称取一定量的FeC2O4·2H2O试样,用硫酸溶解,采用KMnO4滴定法测定,折算结果如下:
n (Fe2+)/mol | n (C2O42-)/mol | 试样中FeC2O4·2H2O的质量分数 |
9.80×10-4 | 9.80×10-4 | 0.980 |
由表中数据推测试样中最主要的杂质是___________
(4)实现步骤④必须用到的两种仪器是_________(供选仪器:a.烧杯;b.坩埚;c.蒸馏烧瓶;d.高温炉;e.表面皿;f.锥形瓶);该步骤的化学方程式是______________________。
(5)为实现步骤⑤,不宜用碳粉还原Fe2O3,理由是________________。