题目内容
【题目】某兴趣小组以废铁屑制得硫酸亚铁铵后,按下列流程制备二水合草酸亚铁(FeC2O4·2H2O),进一步制备高纯度还原铁粉。

已知:FeC2O4·2H2O难溶于水,150℃开始失结晶水;H2C2O4易溶于水,溶解度随温度升高而增大。
请回答:
(1)下列操作或描述正确的是__________。
A.步骤②,H2C2O4稍过量主要是为了抑制Fe2+水解
B.步骤③,采用热水洗涤可提高除杂效果
C.步骤③,母液中的溶质主要是(NH4)2SO4 和H2C2O4
D.步骤③,如果在常压下快速干燥,温度可选择略高于100℃
(2)如图装置,经过一系列操作完成步骤③中的抽滤和洗涤。请选择合适的编号,按正确的操作顺序补充完整(洗涤操作只需考虑一次):
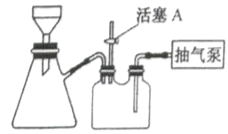
开抽气泵→a→b→d→_________→c→关抽气泵
a.转移固液混合物; b.关活塞A; c.开活塞A; d.确认抽干; e.加洗涤剂洗涤。
(3)称取一定量的FeC2O4·2H2O试样,用硫酸溶解,采用KMnO4滴定法测定,折算结果如下:
n (Fe2+)/mol | n (C2O42-)/mol | 试样中FeC2O4·2H2O的质量分数 |
9.80×10-4 | 9.80×10-4 | 0.980 |
由表中数据推测试样中最主要的杂质是___________
(4)实现步骤④必须用到的两种仪器是_________(供选仪器:a.烧杯;b.坩埚;c.蒸馏烧瓶;d.高温炉;e.表面皿;f.锥形瓶);该步骤的化学方程式是______________________。
(5)为实现步骤⑤,不宜用碳粉还原Fe2O3,理由是________________。
【答案】BD c→e→b→d (NH4)2SO4 bd 4FeC2O4·2H2O+3O2![]() 2Fe2O3+8CO2+8H2O 用炭粉还原会进杂质
2Fe2O3+8CO2+8H2O 用炭粉还原会进杂质
【解析】
硫酸亚铁铵晶体溶解于水,为保证Fe2+完全反应,同时防止Fe2+被氧化,需要加入过量的草酸,生成的草酸亚铁晶体(FeC2O4·2H2O)难溶于水,可通过抽滤、洗涤并干燥获得,将所得晶体在空气中灼烧,得纯氧化铁(Fe2O3),再用CO还原氧化铁得到还原铁粉,据此解答。
硫酸亚铁铵晶体溶解于水,为保证Fe2+完全反应,同时防止Fe2+被氧化,需要加入过量的草酸,生成的草酸亚铁晶体(FeC2O4·2H2O)难溶于水,可通过抽滤、洗涤并干燥获得,将所得晶体在空气中灼烧,得纯氧化铁(Fe2O3),再用CO还原氧化铁得到还原铁粉;
(1)A项,步骤①溶解酸化后溶液已呈酸性,故步骤②时H2C2O4稍过量的主要目的不是酸化抑制Fe2+水解,而是保证Fe2+完全转化为草酸亚铁晶体,同时防止Fe2+被氧化,提高原料利用率,故A项错误;
B项,步骤③,采用热水洗涤可提高草酸的溶解度,提升除杂效果,故B项正确;
C项,酸化和加入稍过量的H2C2O4后,发生反应(NH4)2Fe(SO4)2+ H2C2O4+2H2O= FeC2O4·2H2O↓+(NH4)2SO4+H2SO4,故母液中的溶质主要有(NH4)2SO4、H2SO4和H2C2O4,故C项错误;
D项,根据题给信息,FeC2O4·2H2O 在150℃开始失结晶水,故略高于100℃不影响产物的成分,为使FeC2O4·2H2O快速干燥,可使温度高于100℃,但须低于150℃,故D项正确;
综上所述,本题正确答案为BD。
(2)抽滤完成后,需要洗涤晶体,故应该先打开活塞A,使吸滤瓶内的压强回升,然后添加洗涤剂,待洗涤剂缓慢通过晶体后关闭活塞A,再次确认抽干,打开活塞A防止发生倒吸,最后关闭气泵,正确的顺序为开抽气泵→转移固液混合物→关活塞A→确认抽干→关活塞A→确认抽干→开活塞A→关抽气泵,
故答案为:c→e→b→d;
(3)由图表数据可知,溶液中已知Fe2+和C2O42-的浓度满足电荷守恒,说明杂质中不存在Fe2+或C2O42-,那杂质只能是反应的另一种生成物(NH4)2SO4。
故答案为:(NH4)2SO4;
(4)固体灼烧需要在坩埚内进行,则所需要的仪器有坩埚及加热所需的高温炉,用到的两种仪器是bd;草酸亚铁和O2灼烧时发生反应的化学方程式为4FeC2O4·2H2O+3O2![]() 2Fe2O3+8CO2+8H2O 。
2Fe2O3+8CO2+8H2O 。
故答案为:bd;4FeC2O4·2H2O+3O2![]() 2Fe2O3+8CO2+8H2O ;
2Fe2O3+8CO2+8H2O ;
(5)步骤⑤选用碳粉还原Fe2O3,多余的碳粉会影响铁粉的纯度。
故答案为:用炭粉还原会引进杂质。

 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案