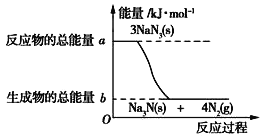
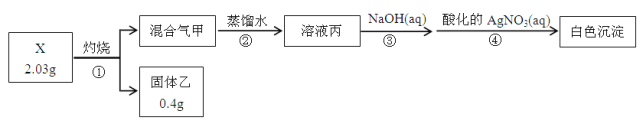
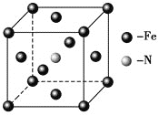
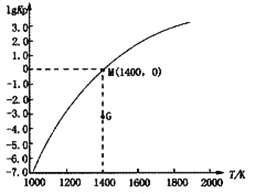
题目内容
【题目】部分短周期元素原子半径的相对大小、最高正价或最低负价随原子序数的变化关系如图所
示:
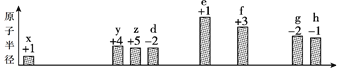
原子序数
下列说法不正确的是( )
A. x、z、d三种元素能形成具有强氧化性的酸
B. 根据g、h的单质与Fe反应的情况,可以判断h的非金属性大于g
C. 工业上通过电解f、h形成的化合物制取f 单质
D. x与其他元素可形成共价化合物或离子化合物
【答案】C
【解析】
利用主族元素的最外层电子数等于所在族序数,以及主要化合价,推出x为H,y为C,z为N,d为O,e为Na,f为Al,g为S,h为Cl,然后进行分析;
利用主族元素的最外层电子数等于所在族序数,以及主要化合价,推出x为H,y为C,z为N,d为O,e为Na,f为Al,g为S,h为Cl,
A、H、N、O可以构成HNO3,HNO3具有强氧化性,也可以构成HNO2,HNO2具有还原性和氧化性,氧化性比还原性突出的多,故A说法正确;
B、Fe与S反应生成FeS,Fe与Cl2反应生成FeCl3,根据形成铁化合物中的铁的化合价,得出Cl的非金属性强于S,故B说法正确;
C、形成的化合物是AlCl3,AlCl3属于共价化合物,熔融状态下不导电,故C说法错误;
D、H与非金属元素,形成共价化合物,H与Na反应生成NaH,NaH为离子化合物,故D说法正确。

练习册系列答案
相关题目