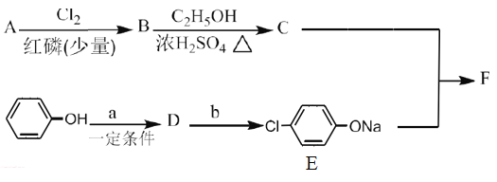
题目内容
【题目】下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题。

(1)③、④、⑤、⑥的离子半径由大到小的顺序是________。(用离子符号表示)
(2)①、③、④、⑥元素可形成多种含10个电子的微粒,其中A和B为分子,C和E为阳离子,D为阴离子;B溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可得C和一种白色沉淀。请写出B、D微粒的电子式:B_______,D________。
并写出A、B、E三种微粒反应的离子方程式____________________________。
(3)由④⑤⑧三种元素组成的某种盐是家用消毒液的主要成分,将该盐溶液滴入KI淀粉溶液中溶液变为蓝色,则反应的离子方程式为________________________。
【答案】N3->O2->Na+>Al3+ ![]()
![]() Al3+ +3NH3+3H2O=Al(OH)3↓+3NH4+ ClO-+2I-+H2O=Cl-+I2+2OH-
Al3+ +3NH3+3H2O=Al(OH)3↓+3NH4+ ClO-+2I-+H2O=Cl-+I2+2OH-
【解析】
根据元素在周期表中的位置关系可知,①、②、③、④、⑤、⑥、⑦和⑧分别是H、C、N、O、Na、Al、Si和Cl,再结合元素周期律与物质结构与性质作答,
(1)四种元素对应的简单离子电子层数相同,依据离子半径规律作答;
(2)①、③、④、⑥元素可形成多种含10个电子的微粒,其中A和B为分子,C为阳离子,D为阴离子,B溶于A后所得的物质可电离出C和D,则可知涉及的反应为氨气溶于水后生成一水合氨,可电离出铵根离子与氢氧根离子,则推出B为氨气,A为水,C为铵根离子,D为氢氧根离子;又A、B、E三种微粒反应后可得C和一种白色沉淀,则可知E为氯离子,涉及的离子反应为铝离子与一水合氨反应生成氢氧化铝沉淀与铵根离子,据此分析作答;
(3)由④⑤⑧三种元素组成的某种盐是家用消毒液的主要成分,则该盐为NaClO,将该盐溶液滴入KI淀粉溶液中溶液变为蓝色,发生氧化还原反应,据此分析。
根据上述分析可知,①、②、③、④、⑤、⑥、⑦和⑧分别是H、C、N、O、Na、Al、Si和Cl,
(1)电子层数相同时,核电荷数越小,离子半径越大,则③、④、⑤、⑥的离子半径由大到小的顺序是N3->O2->Na+>Al3+;
(2)根据上述分析可知B为氨气,其电子式为:![]() ;D为氢氧根离子,其电子式为:
;D为氢氧根离子,其电子式为:![]() ;
;
A、B、E三种微粒反应的离子方程式为:Al3+ +3NH3+3H2O=Al(OH)3↓+3NH4+;
(3)由④⑤⑧三种元素组成的NaClO与KI发生氧化还原反应,其离子方程式为:ClO-+2I-+H2O=Cl-+I2+2OH-。

 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案