题目内容
【题目】下列说法正确的是( )
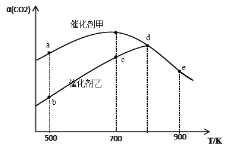
A.因为反应物浓度越大,反应速率越快,所以常温下,相同的铝片中分别加入足量的浓硝酸、稀硝酸中,浓硝酸中铝片先溶解完
B.增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成H2的速率
C.N2(g)+3H2(g)![]() 2NH3(g)ΔH<0,其他条件不变时升高温度,反应速率v(H2)和H2的转化率均增大
2NH3(g)ΔH<0,其他条件不变时升高温度,反应速率v(H2)和H2的转化率均增大
D.对于反应2H2O2===2H2O+O2↑,加入MnO2或升高温度都能加快O2的生成速率
【答案】D
【解析】
A. 常温下,铝片遇浓硝酸钝化,在铝片表面生成一层致密的氧化物薄膜,阻止与铝片进一步反应,铝片不能溶解,A项错误;
B. 浓硫酸使铁钝化,在铁表面生成一层致密的氧化物薄膜,阻止与铁进一步反应,所以浓硫酸与铁不能反应生成H2,B项错误;
C. 该反应正反应为放热反应,升高温度,平衡向吸热反应方向移动,即逆向移动,则氢气的转化率减小,C项错误;
D. 加入催化剂或升高温度都可以使过氧化氢分解速率加快,D项正确;
答案选D。

【题目】工业上利用电镀污泥(主要含有Fe2O3、CuO、Cr2O3及部分难溶杂质)回收铜和铬等金属,回收流程如图1:
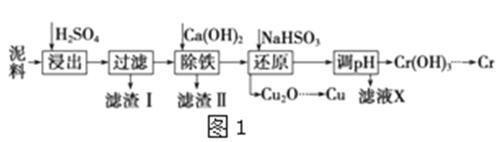
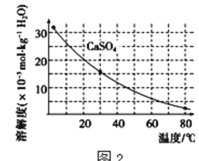
已知部分物质沉淀的pH及CaSO4的溶解度曲线如图2:
Fe3+ | Cu2+ | Cr3+ | |
开始沉淀pH | 2.1 | 4.7 | 4.3 |
完全沉淀pH | 3.2 | 6.7 | a |
(1)在浸出过程中除了生成Fe2(SO4)3、Cr2(SO4)3外,主要还有__;
(2)在除铁操作中,需要除去Fe3+和CaSO4,请完成相关操作:①加入石灰乳调节pH到约__,检验Fe3+已经除尽的操作是__;②将浊液加到80℃,__;
(3)写出还原步骤中加入NaHSO3生成Cu2O固体反应的离子方程式__,此步骤中加入NaHSO3得到Cu2O的产率为95%,若NaHSO3过量,除了浪费试剂外,还会出现的问题是__;
(4)在FeS饱和溶液中存在:FeS(s)![]() Fe2+(aq)+S2-(aq),常温下FeS的Ksp=6.25×10-18。又知FeS饱和溶液中c(H+)与c(S2-)之间存在以下限量关系:c2(H+)c(S2-)=1.0×10-22,为了使溶液中c(Fe2+)达到1molL-1,现将适量FeS投入其饱和溶液中,应调节溶液中的c(H+)为___。
Fe2+(aq)+S2-(aq),常温下FeS的Ksp=6.25×10-18。又知FeS饱和溶液中c(H+)与c(S2-)之间存在以下限量关系:c2(H+)c(S2-)=1.0×10-22,为了使溶液中c(Fe2+)达到1molL-1,现将适量FeS投入其饱和溶液中,应调节溶液中的c(H+)为___。