题目内容
【题目】下列有关平衡常数的说法正确的是( )
A.已知K=![]() ,则对应的化学反应可以表示为:2CO2(g) + 6H2(g)
,则对应的化学反应可以表示为:2CO2(g) + 6H2(g)![]() CH3CH2OH(g)+3H2O(g)
CH3CH2OH(g)+3H2O(g)
B.化学平衡常数K与温度有关,随温度的升高,K可能增大也可能减小
C.常温下,向纯水中加入碳酸钠,水的电离程度变大,Kw变大
D.将某浓度氢氟酸溶液升高温度,氢氟酸的电离平衡常数Ka将变大
【答案】B
【解析】
A.在化学平衡常数表达式中,分子为生成物的浓度幂之积,分母为反应物的浓度幂之积,A错误;
B.一个化学反应,要么吸热,要么放热,温度升高,平衡可能正向移动,K增大,也可能逆向移动,K减小,B正确;
C.虽然碳酸钠的加入,使水的电离程度变大,但温度不变,Kw只与温度有关,所以Kw不变,C错误;
D. 氢氟酸的电离过程放热,升高温度,氢氟酸电离平衡逆向移动,所以电离平衡常数Ka将变小,D错误。
故选B。

 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案【题目】对硝基甲苯是医药、染料等工业的一种重要有机中间体,它常以浓硝酸为硝化剂,浓硫酸为催化剂,通过甲苯的硝化反应制备。

一种新的制备对硝基甲苯的实验方法是:以发烟硝酸为硝化剂,固体NaHSO4为催化剂(可循环使用),在CCl4溶液中,加入乙酸酐(有脱水作用),45℃反应1h 。反应结束后,过滤,滤液分别用5% NaHCO3溶液、水洗至中性,再经分离提纯得到对硝基甲苯。
(1)上述实验中过滤的目的是________________________。
(2)滤液在分液漏斗中洗涤静置后,有机层处于______层(填“上”或'下”);放液时,若发现液体流不下来,其可能原因除分液漏斗活塞堵塞外,还有_______________。
(3)下列给出了催化剂种类及用量对甲苯硝化反应影响的实验结果。
催化剂 | n(催化剂) | 硝化产物中各种异构体质量分数(%) | 总产率(%) | ||
对硝基甲苯 | 邻硝基甲苯 | 间硝基甲苯 | |||
浓H2SO4 | 1.0 | 35.6 | 60.2 | 4.2 | 98.0 |
1.2 | 36.5 | 59.5 | 4.0 | 99.8 | |
NaHSO4 | 0.15 | 44.6 | 55.1 | 0.3 | 98.9 |
0.25 | 46.3 | 52.8 | 0.9 | 99.9 | |
0.32 | 47.9 | 51.8 | 0.3 | 99.9 | |
0.36 | 45.2 | 54.2 | 0.6 | 99.9 | |
①NaHSO4催化制备对硝基甲苯时,催化剂与甲苯的最佳物质的量之比为______________。
②由甲苯硝化得到的各种产物的含量可知,甲苯硝化反应的特点是___________________。
③与浓硫酸催化甲苯硝化相比,NaHSO4催化甲苯硝化的优点有____________。
【题目】某化学兴趣小组对加碘食盐中的KIO3进行研究,它是一种白色粉末,常温下很稳定。在酸性条件下KIO3是一种较强的氧化剂,与HI、H2O2等作用,被还原为碘单质。 学生甲设计实验测出加碘食盐中碘元素的含量,步骤如下:
a.称取mg加碘盐,加适量蒸馏水溶解;
b.用稀硫酸酸化,再加入过量KI溶液;发生反应:IO3﹣+5I﹣+6H+=3I2+3H2O,将反应后的溶液加水稀释至100.00 mL。
c.取10.00mL上述溶液到锥形瓶中,以淀粉为指示剂,用物质的量浓度为3.0molL﹣1的 Na2S2O3溶液滴定(滴定时的反应方程式:I2+2S2O32﹣═2I﹣+S4O62﹣)。
d.重复实验2次,三次实验分别记录有关数据如下:
滴定次数 | 待测溶液的体积/mL | 1.00×10﹣3molL﹣1的 Na2S2O3溶液的体积(mL) | |
滴定前刻度 | 滴定后刻度 | ||
第一次 | 10.00 | 2.62 | 22.60 |
第二次 | 10.00 | 7.56 | 30.30 |
第三次 | 10.00 | 6.22 | 26.24 |
试回答:
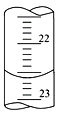
(1)如下图,是某次滴定时的滴定管中的液面,其读数为___________mL。
(2)判断到达滴定终点的现象是:_______________________。
(3)滴定时,Na2S2O3溶液应放在______________ (填“酸式滴定管”或“碱式滴定管”)。
(4)根据实验测定数据,计算加碘食盐样品中的碘元素百分含量是_______(以含m的代数式表示)。
(5)根据上述实验对下列假定情况进行讨论,导致测出待测液的浓度是(填“偏小”、“偏大”或“无影响”)
①标准液读数时,若滴定前俯视,滴定后仰视,测出待测液的浓度__________
②盛标准液的滴定管,滴定前滴定管尖端有气泡,滴定后气泡消失,测出待测液的浓度___