��Ŀ����
����Ŀ�������а��ֻ��ţ��ٱ�������ȩ�������ǻ������Ȼ������һ�������ԭ�ӣ�-Cl�����������Ȼ���������ϣ����γɻ����д���������������Ļ����
��1����������ԭ����������2�����������ԣ������ܺ�̼�����Ʒ�Ӧ_______________
��2��������ֻ��1����ԭ�ӣ��ܷ���������Ӧ�����ʣ�������ȩ�ͼ����ȣ�Cl-CHO����У�д���ƣ�__________��д�������л����������Ӧ�Ļ�ѧ����ʽ_________
��3��������ֻ��1����ԭ�ӣ����ܸ��������Ʒ�Ӧ�����ܹ�����������Ӧ���л��д���ƣ�________��д�������л������һ����Է�����������л����������Ӧ�Ļ�ѧ����ʽ______________.
���𰸡�![]() ��HClO ��ȩ CH3CH2CHO+2Ag(NH3)2OH
��HClO ��ȩ CH3CH2CHO+2Ag(NH3)2OH![]() CH3CH2COONH4+2Ag��+3NH3+H2O �Ҵ� HCOOH+CH3CH2OH
CH3CH2COONH4+2Ag��+3NH3+H2O �Ҵ� HCOOH+CH3CH2OH![]() HCOOCH2CH3+H2O
HCOOCH2CH3+H2O
��������
��1�����ܺ�̼�����Ʒ�Ӧ��˵����������COOH�������Ա�̼������
��2���ܷ���������Ӧ��˵��������CHO��
��3��������ֻ��1����ԭ�ӣ��ܹ�����������Ӧ�����ܸ��������Ʒ�Ӧ˵�������ǻ���
��1����������ԭ����������2�������ܺ�̼�����Ʒ�Ӧ��˵����������COOH�������Ա�̼�����������������Т٢۽�����ɱ��ӣ��ۢ��Ϊ�����ᣬ�ṹ��ʽ�ֱ�Ϊ![]() ��HClO��
��HClO��
��2���ܷ���������Ӧ��˵��������CHO��������ֻ��1����ԭ�ӣ�������ȩ�ͼ����ȣ�Cl-CHO���⣬���Тڢݽ�����ɱ�ȩ����ȩ����������Ӧ�Ļ�ѧ����ʽΪCH3CH2CHO+2Ag(NH3)2OH![]() CH3CH2COONH4+2Ag��+3NH3+H2O��
CH3CH2COONH4+2Ag��+3NH3+H2O��
��3��������ֻ��1����ԭ�ӣ��ܹ�����������Ӧ�����ܸ��������Ʒ�Ӧ˵�������ǻ��������������Ǣۢݽ�ϳ��Ҵ������Ҵ���Է�����������������Ҵ�����������Ӧ������Ϊ���ᣬ������������Ӧ�ķ���ʽΪHCOOH+CH3CH2OH![]() HCOOCH2CH3+H2O��
HCOOCH2CH3+H2O��

 ��һ������Ԫͬ�����ؾ�ϵ�д�
��һ������Ԫͬ�����ؾ�ϵ�д�����Ŀ��ij��ѧ��ȤС��Լӵ�ʳ���е�KIO3�����о�������һ�ְ�ɫ��ĩ�������º��ȶ���������������KIO3��һ�ֽ�ǿ������������HI��H2O2�����ã�����ԭΪ�ⵥ�ʡ� ѧ�������ʵ�����ӵ�ʳ���е�Ԫ�صĺ������������£�
a����ȡmg�ӵ��Σ�����������ˮ�ܽ⣻
b����ϡ�����ữ���ټ������KI��Һ��������Ӧ��IO3��+5I��+6H+=3I2+3H2O������Ӧ�����Һ��ˮϡ����100.00 mL��
c��ȡ10.00mL������Һ����ƿ�У��Ե���Ϊָʾ���������ʵ���Ũ��Ϊ3.0molL��1�� Na2S2O3��Һ�ζ�(�ζ�ʱ�ķ�Ӧ����ʽ��I2+2S2O32���T2I��+S4O62��)��
d���ظ�ʵ��2�Σ�����ʵ��ֱ��¼�й��������£�
�ζ����� | ������Һ�����/mL | 1.00��10��3molL��1�� Na2S2O3��Һ�����(mL) | |
�ζ�ǰ�̶� | �ζ���̶� | ||
��һ�� | 10.00 | 2.62 | 22.60 |
�ڶ��� | 10.00 | 7.56 | 30.30 |
������ | 10.00 | 6.22 | 26.24 |
�Իش�
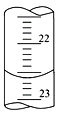
��1������ͼ����ij�εζ�ʱ�ĵζ����е�Һ�棬�����Ϊ___________mL��
��2���жϵ���ζ��յ�������ǣ�_______________________��
��3���ζ�ʱ��Na2S2O3��ҺӦ����______________ (������ʽ�ζ�����������ʽ�ζ�����)��
��4������ʵ��ⶨ���ݣ�����ӵ�ʳ����Ʒ�еĵ�Ԫ�ذٷֺ�����_______(�Ժ�m�Ĵ���ʽ��ʾ)��
��5����������ʵ������мٶ������������,���²������Һ��Ũ����(����ƫС������ƫ����������Ӱ����)
�ٱ�Һ����ʱ�����ζ�ǰ���ӣ��ζ������ӣ��������Һ��Ũ��__________
��ʢ��Һ�ĵζ��ܣ��ζ�ǰ�ζ��ܼ�������ݣ��ζ���������ʧ���������Һ��Ũ��___
����Ŀ����������![]() ���л��ϳɵij��û�ԭ����һ���Ʊ������ǽ�����
���л��ϳɵij��û�ԭ����һ���Ʊ������ǽ�����![]() �����ռ���Һ��ϡ����ȣ����ɴ������ƺ�
�����ռ���Һ��ϡ����ȣ����ɴ������ƺ�![]() ��
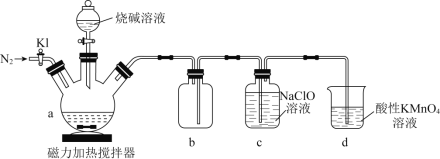
��![]() ��һ����ɫ���ж��Ŀ�ȼ�����塣ʵ��װ����ͼ��ʾ��
��һ����ɫ���ж��Ŀ�ȼ�����塣ʵ��װ����ͼ��ʾ��
�ش��������⣺
(1)��a�м�����ס�����̿��ĩ����![]() ��ͨ��
��ͨ��![]() һ��ʱ�䣬�ر�
һ��ʱ�䣬�ر�![]() ���������Ƚ��������μ��ռ���Һ��
���������Ƚ��������μ��ռ���Һ��
�ٻ���̿��ĩ��Ϊ���ķ�ɢ����ԭ����_______��b������______________��
��![]() �з�Ӧ�Ļ�ѧ����ʽΪ_______________________________��
�з�Ӧ�Ļ�ѧ����ʽΪ_______________________________��
(2)��Ӧ������![]() ������ͨ��
������ͨ��![]() ��Ŀ����______________________________��d��������__________________��
��Ŀ����______________________________��d��������__________________��
(3)![]() ������
������![]() ��NaCl����������ܽ��
��NaCl����������ܽ��![]() ���£�
���£�
|
| |
NaCl | 37 | 39 |
| 100 | 667 |
��ַ�Ӧ��c�л��Һ����Ũ�����д��������������þ�����Ҫ�ɷֵĻ�ѧʽΪ_____________��Ȼ��________________��______________�����ˡ�ϴ�ӡ�����õ���![]() �Ĵֲ�Ʒ��
�Ĵֲ�Ʒ��
(4)��Ʒ���Ȳⶨ��
ȡ��Ʒm�����![]() ��Һ��ȡ25mL����ƿ�У��ữ�����
��Һ��ȡ25mL����ƿ�У��ữ�����![]() ��ˮ���ڰ�����ַ�Ӧ���Ե�����Һ��ָʾ������
��ˮ���ڰ�����ַ�Ӧ���Ե�����Һ��ָʾ������![]() ��Һ�ζ����յ㣬ƽ������VmL����ط�Ӧ����ʽΪ��
��Һ�ζ����յ㣬ƽ������VmL����ط�Ӧ����ʽΪ��![]() ��
��![]() ����Ʒ���ȱ���ʽΪ________________��
����Ʒ���ȱ���ʽΪ________________��
����Ŀ����������ʵ���������������������������ȷ�ģ� ��
ѡ�� | ʵ����������� | ���� |
A | ���������������ש���������ȡ����ȡҺ��ʹKMnO4��Һ��ɫ | ��ȡҺ�к�Fe2+ |
B | �����£���ñ���Na2CO3 ��Һ��pH���ڱ���NaHCO3 ��Һ��pH | ������ˮ��̶� |
C | 25��ʱ����AgNO3��Һ�еμ�����NaCl��Һ�����ٲ���������Ȼ��μ�KI��Һ���л�ɫ�������� | 25��ʱ��Ksp��AgCl��>Ksp��AgI�� |
D | ��Cl2ͨ����з�̪��NaOH��Һ����Һ��ɫ | Cl2����Ư���� |
A.AB.BC.CD.D