题目内容
【题目】根据如图能量关系示意图,下列说法正确的是
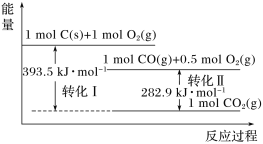
A. 1 mol C(s)与1 mol O2(g)的能量之和为393.5 kJ
B. 反应2CO(g)+O2(g)= 2CO2(g)中,生成物的总能量大于反应物的总能量
C. 由C(s)→CO(g)的热化学方程式为:2C(s)+O2(g)= 2CO(g) ΔH=-221.2 kJ·mol-1
D. 热值指一定条件下单位质量的物质完全燃烧所放出热量,则CO热值ΔH=-10.1 kJ·mol-1
【答案】C
【解析】
由图可知,转化Ⅰ反应物总能量大于生成物总能量,为放热反应,热化学方程式为C(s)+O2(g)= CO2(g) ΔH=-393.5 kJ·mol-1,转化Ⅱ反应物总能量大于生成物总能量,为放热反应,热化学方程式为2CO(g)+O2(g)= 2CO2(g) ΔH=-282.9kJ·mol-1,转化Ⅰ—转化Ⅱ得C(s)→CO(g)的热化学方程式2C(s)+O2(g)= 2CO(g) ΔH=-221.2 kJ·mol-1。
A项、由图可知1 mol C(s)与1 mol O2(g)的能量比1 mol CO2(g)能量高393.5 kJ,故A错误;
B项、由图可知反应2CO(g)+O2(g)= 2CO2(g)为放热反应,生成物的总能量小于反应物的总能量,故B错误;
C项、由图可知1 mol C(s)与O2(g)生成1 mol CO(g)放出热量为393.5 kJ-282.9 kJ=110.6 kJ,则C(s)→CO(g)的热化学方程式为2C(s)+O2(g)= 2CO(g) ΔH=-221.2 kJ·mol-1,故C正确;
D项、热值指一定条件下单位质量的物质完全燃烧所放出热量,则CO的热值为282.9 kJ×![]() g≈10.1 kJ·g-1,故D错误;
g≈10.1 kJ·g-1,故D错误;
故选C。

【题目】某化学兴趣小组对加碘食盐中的KIO3进行研究,它是一种白色粉末,常温下很稳定。在酸性条件下KIO3是一种较强的氧化剂,与HI、H2O2等作用,被还原为碘单质。 学生甲设计实验测出加碘食盐中碘元素的含量,步骤如下:
a.称取mg加碘盐,加适量蒸馏水溶解;
b.用稀硫酸酸化,再加入过量KI溶液;发生反应:IO3﹣+5I﹣+6H+=3I2+3H2O,将反应后的溶液加水稀释至100.00 mL。
c.取10.00mL上述溶液到锥形瓶中,以淀粉为指示剂,用物质的量浓度为3.0molL﹣1的 Na2S2O3溶液滴定(滴定时的反应方程式:I2+2S2O32﹣═2I﹣+S4O62﹣)。
d.重复实验2次,三次实验分别记录有关数据如下:
滴定次数 | 待测溶液的体积/mL | 1.00×10﹣3molL﹣1的 Na2S2O3溶液的体积(mL) | |
滴定前刻度 | 滴定后刻度 | ||
第一次 | 10.00 | 2.62 | 22.60 |
第二次 | 10.00 | 7.56 | 30.30 |
第三次 | 10.00 | 6.22 | 26.24 |
试回答:
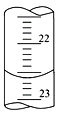
(1)如下图,是某次滴定时的滴定管中的液面,其读数为___________mL。
(2)判断到达滴定终点的现象是:_______________________。
(3)滴定时,Na2S2O3溶液应放在______________ (填“酸式滴定管”或“碱式滴定管”)。
(4)根据实验测定数据,计算加碘食盐样品中的碘元素百分含量是_______(以含m的代数式表示)。
(5)根据上述实验对下列假定情况进行讨论,导致测出待测液的浓度是(填“偏小”、“偏大”或“无影响”)
①标准液读数时,若滴定前俯视,滴定后仰视,测出待测液的浓度__________
②盛标准液的滴定管,滴定前滴定管尖端有气泡,滴定后气泡消失,测出待测液的浓度___
【题目】次磷酸钠![]() 是有机合成的常用还原剂,一般制备方法是将黄磷
是有机合成的常用还原剂,一般制备方法是将黄磷![]() 和过量烧碱溶液混合、加热,生成次磷酸钠和
和过量烧碱溶液混合、加热,生成次磷酸钠和![]() 。
。![]() 是一种无色、有毒的可燃性气体。实验装置如图所示:
是一种无色、有毒的可燃性气体。实验装置如图所示:
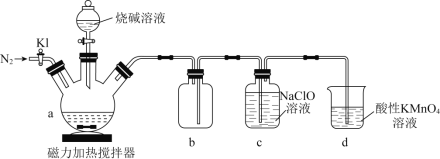
回答下列问题:
(1)在a中加入黄磷、活性炭粉末,打开![]() ,通入
,通入![]() 一段时间,关闭
一段时间,关闭![]() ,打开磁力加热搅拌器,滴加烧碱溶液。
,打开磁力加热搅拌器,滴加烧碱溶液。
①活性炭粉末作为黄磷的分散剂,原理是_______;b的作用______________。
②![]() 中反应的化学方程式为_______________________________。
中反应的化学方程式为_______________________________。
(2)反应结束后,打开![]() ,继续通入
,继续通入![]() ,目的是______________________________。d的作用是__________________。
,目的是______________________________。d的作用是__________________。
(3)![]() 中生成
中生成![]() 和NaCl,相关物质溶解度
和NaCl,相关物质溶解度![]() 如下:
如下:
|
| |
NaCl | 37 | 39 |
| 100 | 667 |
充分反应后,将c中混合液蒸发浓缩,有大量晶体析出,该晶体主要成分的化学式为_____________,然后________________、______________、过滤、洗涤、干燥,得到含![]() 的粗产品。
的粗产品。
(4)产品纯度测定:
取产品m克配成![]() 溶液,取25mL于锥形瓶中,酸化后加入
溶液,取25mL于锥形瓶中,酸化后加入![]() 碘水,于暗处充分反应后,以淀粉溶液做指示剂,用
碘水,于暗处充分反应后,以淀粉溶液做指示剂,用![]() 溶液滴定至终点,平均消耗VmL。相关反应方程式为:
溶液滴定至终点,平均消耗VmL。相关反应方程式为:![]() ,
,![]() 。产品纯度表达式为________________。
。产品纯度表达式为________________。