题目内容
16.根据下列几种物质熔点和沸点的数据,判断下列说法中错误的是( )| NaCl | MgCl2 | AlCl3 | SiCl4 | 单质B | |
| 熔点/℃ | 810 | 710 | 190 | -68 | 2 300 |
| 沸点/℃ | 1 465 | 1418 | 182.7 | 57 | 2 500 |
| A. | SiCl4是分子晶体 | B. | 单质B可能是原子晶体 | ||
| C. | AlCl3加热能升华 | D. | KCl的熔点大于810℃ |
分析 A.根据SiCl4的物理性质分析;
B.根据单质B的熔沸点分析;
C.由表中数据可知AlCl3的沸点比熔点低;
D.KCl、NaCl均为离子晶体,晶格能大的熔点高,晶格能与离子半径与离子电荷有关,半径越大,晶格能越小.
解答 解:A.由表中数据可知,SiCl4的熔沸点较低,属于分子晶体,故A正确;
B.单质B的熔沸点很高,所以单质B是原子晶体,故B正确;
C.由表中数据可知AlCl3的沸点比熔点低,所以AlCl3加热能升华,故C正确;
D.KCl、NaCl均为离子晶体,决定晶格能的因素为:离子电荷、离子半径,钾离子的半径大于钠离子,所带电荷相同,KCl的熔点低于NaCl,KCl的熔点小于810℃,故D错误;
故选D.
点评 本题主要考查了不同类型晶体的熔沸点高低及决定熔沸点的因素,注意离子晶体晶格能大的熔点高,题目难度不大.

练习册系列答案
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案
相关题目
3.下列说法正确的是( )
| A. | 冰中每个水分子平均形成两个氢键 | |
| B. | 冰、“可燃冰”、干冰都具有分子密堆积特征 | |
| C. | 分子晶体中一定不存在单个的原子 | |
| D. | “可燃冰”不属于分子晶体 |
4.利用如图所示装置进行下列实验,能得出相应实验结论的是( )
| 选项 | ① | ② | ③ | 实验结论 |  |
| A | 稀硫酸 | Na2S | AgNO3与AgCl的浊液 | Ksp(AgCl)>Ksp(Ag2S) | |
| B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 | |
| C | 浓硫酸 | Na2SO3 | 品红溶液 | SO2具有漂白性 | |
| D | 浓硝酸 | Na2CO3 | Na2SiO3溶液 | 酸性:硝酸>碳酸>硅酸 |
| A. | A | B. | B | C. | C | D. | D |
1.下列关于碳氢化合物的叙述正确的是( )
| A. |  2-甲基-1-丙醇 2-甲基-1-丙醇 | |
| B. | 石油的主要成分是碳氢化合物 | |
| C. | 碳氢化合物中的化学键都是极性键 | |
| D. | 常压下,正戊烷、异戊烷、新戊烷的沸点依次增大 |
8.下列说法正确的是( )
| A. | 在粗硅的制取中发生反应2C+SiO2$\frac{\underline{\;高温\;}}{\;}$2CO↑+Si,硅被还原,可推知碳的非金属性强于硅的非金属性 | |
| B. | 由“同温度下等浓度的Na2CO3溶液比Na2SO4溶液的pH大”,可推知C比S的非金属性弱 | |
| C. | 向某溶液中加入稀盐酸,能产生使澄清石灰水变浑浊的气体,说明该溶液中一定含有CO32- | |
| D. | 由“某过程发生化学键断裂”,可推知该过程发生了化学变化 |
5.下列几组判断均正确的是( )
①${\;}_1^1H$和${\;}_1^2H$互为同位素 ② 和
和 为同一物质③
为同一物质③ 和
和 为同分异构体④O2和O3互为同素异形体⑤
为同分异构体④O2和O3互为同素异形体⑤ 和
和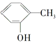 为同系物 ⑥
为同系物 ⑥ 和
和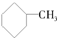 为芳香化合物( )
为芳香化合物( )
①${\;}_1^1H$和${\;}_1^2H$互为同位素 ②
 和
和 为同一物质③
为同一物质③ 和
和 为同分异构体④O2和O3互为同素异形体⑤
为同分异构体④O2和O3互为同素异形体⑤ 和
和 为同系物 ⑥
为同系物 ⑥ 和
和 为芳香化合物( )
为芳香化合物( )| A. | ①③④⑥ | B. | ①②④⑤ | C. | ①②⑤⑥ | D. | ②③④⑤ |
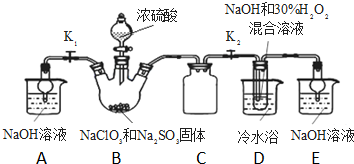 亚氯酸钠(NaClO2)是重要漂白剂.探究小组开展如下实验,回答下列问题:
亚氯酸钠(NaClO2)是重要漂白剂.探究小组开展如下实验,回答下列问题: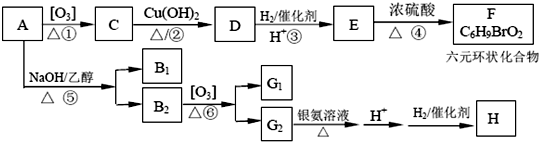
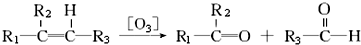
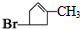 ;B1 的分子式为C6H8.
;B1 的分子式为C6H8.
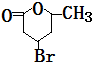 +H2O.
+H2O.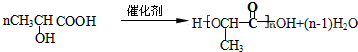 .
.