题目内容
18.常温下,下列各组离子在指定溶液中能大量共存的是( )| A. | 甲基橙呈红色的溶液:NH4+、Ba2+、AlO2-、Cl- | |
| B. | 加NaOH后加热有气体放出且有沉淀生成的溶液:Ca2+、HCO3-、NH4+、CH3COO- | |
| C. | 与铝反应产生大量氢气的溶液:NH4+、Na+、CO32-、NO3- | |
| D. | 遇苯酚显紫色的溶液:I-、K+、SO42-、Mg2+ |
分析 A.甲基橙呈红色的溶液,pH<3.1,溶液显酸性;
B.加NaOH后,与Ca2+、HCO3-反应生成碳酸钙,NaOH与NH4+反应生成氨气;
C.与铝反应产生大量氢气的溶液,为非氧化性酸或强碱溶液;
D.遇苯酚显紫色的溶液含Fe3+,离子之间发生氧化还原反应.
解答 解:A.甲基橙呈红色的溶液,pH<3.1,溶液显酸性,不能大量存在AlO2-,故A不选;
B.加NaOH后,与Ca2+、HCO3-反应生成碳酸钙,加热NaOH与NH4+反应生成氨气,符合题意,故B选;
C.与铝反应产生大量氢气的溶液,为非氧化性酸或强碱溶液,酸溶液中不能大量存在CO32-,碱溶液中不能大量存在NH4+,故C不选;
D.遇苯酚显紫色的溶液含Fe3+,与I-发生氧化还原反应,不能大量共存,故D不选;
故选B.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应、氧化还原反应的离子共存考查,综合性较强,题目难度不大.

练习册系列答案
相关题目
8.下列说法正确的是( )
| A. | 在粗硅的制取中发生反应2C+SiO2$\frac{\underline{\;高温\;}}{\;}$2CO↑+Si,硅被还原,可推知碳的非金属性强于硅的非金属性 | |
| B. | 由“同温度下等浓度的Na2CO3溶液比Na2SO4溶液的pH大”,可推知C比S的非金属性弱 | |
| C. | 向某溶液中加入稀盐酸,能产生使澄清石灰水变浑浊的气体,说明该溶液中一定含有CO32- | |
| D. | 由“某过程发生化学键断裂”,可推知该过程发生了化学变化 |
13.在Fe(NO3)2溶液中存在下列平衡:Fe2++2H2O?2Fe(OH)2+2H+,又已知Fe2+的颜色为浅绿色.现向该溶液中加入稀盐酸,则溶液的颜色为( )
| A. | 无变化 | B. | 变为无色 | C. | 变为深绿色 | D. | 变为棕黄色 |
3.下列情况能通过置换反应得到金属铁的是( )
| A. | Na与FeCl2溶液常温混合 | B. | CO通过灼热的Fe2O3 | ||
| C. | H2通入FeSO4溶液 | D. | Al和Fe3O4混合加热至高温 |
7.下列反应中是吸热反应的是( )
| A. | 氧化钙溶于水 | B. | 乙醇燃烧 | ||
| C. | 铝粉与氧化铁粉末反应 | D. | 碳酸钙受热分解 |
8. 铅蓄电池是常用的汽车电池.其结构如图所示.铅蓄电池以铅板为负极,表面蒙有大量二氧化铅的铅板作正极,以适当浓度的H2SO4作电解质溶液.已知PbSO4不溶于水也不溶于H2SO4.此电池放电的原理与普通原电池相同,充电时则相当于电解池.下列关于铅蓄电池的说法中正确的是( )
铅蓄电池是常用的汽车电池.其结构如图所示.铅蓄电池以铅板为负极,表面蒙有大量二氧化铅的铅板作正极,以适当浓度的H2SO4作电解质溶液.已知PbSO4不溶于水也不溶于H2SO4.此电池放电的原理与普通原电池相同,充电时则相当于电解池.下列关于铅蓄电池的说法中正确的是( )
 铅蓄电池是常用的汽车电池.其结构如图所示.铅蓄电池以铅板为负极,表面蒙有大量二氧化铅的铅板作正极,以适当浓度的H2SO4作电解质溶液.已知PbSO4不溶于水也不溶于H2SO4.此电池放电的原理与普通原电池相同,充电时则相当于电解池.下列关于铅蓄电池的说法中正确的是( )
铅蓄电池是常用的汽车电池.其结构如图所示.铅蓄电池以铅板为负极,表面蒙有大量二氧化铅的铅板作正极,以适当浓度的H2SO4作电解质溶液.已知PbSO4不溶于水也不溶于H2SO4.此电池放电的原理与普通原电池相同,充电时则相当于电解池.下列关于铅蓄电池的说法中正确的是( )| A. | 放电时,负极质量减小,正极质量增大 | |
| B. | 放电时,当电路中通过2mol e-时,消耗2mol H2SO4 | |
| C. | 放电时,溶液中SO${\;}_{4}^{2-}$向正极区移动 | |
| D. | 放电时,整个电解质溶液的pH逐渐变大 |
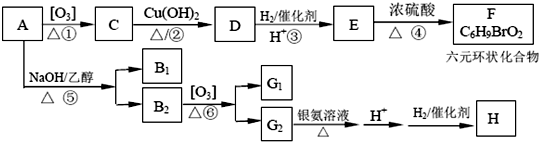
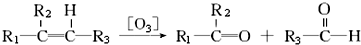
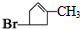 ;B1 的分子式为C6H8.
;B1 的分子式为C6H8.
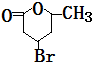 +H2O.
+H2O.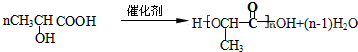 .
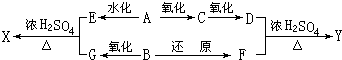
.
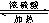 HCOOC2H5+H2O.
HCOOC2H5+H2O.