题目内容
12.下列说法正确的是( )| A. | 离子化合物只能由金属元素和非金属元素组成 | |
| B. | 离子化合物只能存在离子键 | |
| C. | HCl能电离出氢离子和氯离子,所以HCl存在离子键 | |
| D. | 共价化合物中不可能存在离子键 |
分析 A.离子化合物中可能只含非金属元素;
B.离子化合物中可能存在共价键;
C.HCl能电离出氢离子和氯离子,但HCl分子中H-Cl原子之间只存在共价键;
D.只含共价键的化合物是共价化合物.
解答 解:A.离子化合物中可能只含非金属元素,如铵盐,故A错误;
B.离子化合物中可能存在共价键,如KOH等,故B错误;
C.HCl能电离出氢离子和氯离子,但HCl分子中H-Cl原子之间只存在共价键,所以HCl属于共价化合物,故C错误;
D.只含共价键的化合物是共价化合物,共价化合物中一定不含离子键,故D正确;
故选D.
点评 本题考查离子化合物和共价化合物的判断,侧重考查基本概念,明确二者区别是解本题关键,注意化合物类型与化学键的关系,题目难度不大.

练习册系列答案
 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案
相关题目
2.化学式为C7H16的烷烃中,在结构式中含有3个甲基的同分异构体数目是( )
| A. | 2 | B. | 3 | C. | 4 | D. | 5 |
7.在下列影响化学反应速率的外界因素中,肯定能使化学反应速率加快的方法是( )
①升高温度 ②加入正催化剂 ③增大反应物浓度 ④将块状固体反应物磨成粉末 ⑤增大压强.
①升高温度 ②加入正催化剂 ③增大反应物浓度 ④将块状固体反应物磨成粉末 ⑤增大压强.
| A. | ①②③④ | B. | ①②④⑤ | C. | ①③④⑤ | D. | ①②③④⑤ |
4.在钢铁的生锈过程中(吸氧腐蚀)可能发生的反应是( )
| A. | 4Fe+3O2═2Fe2O3 | B. | O2+4e-+2H2O═4OH- | ||
| C. | 4Fe(OH)2+O2+2H2O═4Fe(OH)3 | D. | Fe+2H+═Fe2++H2↑ |
15. “盐水动力”玩具车的电池以镁片、活性炭为电极,向极板上滴加食盐水后电池便可工作,电池反应为2Mg+O2+2H2O=2Mg(OH)2.下列关于该电池的说法错误的是( )
“盐水动力”玩具车的电池以镁片、活性炭为电极,向极板上滴加食盐水后电池便可工作,电池反应为2Mg+O2+2H2O=2Mg(OH)2.下列关于该电池的说法错误的是( )
 “盐水动力”玩具车的电池以镁片、活性炭为电极,向极板上滴加食盐水后电池便可工作,电池反应为2Mg+O2+2H2O=2Mg(OH)2.下列关于该电池的说法错误的是( )
“盐水动力”玩具车的电池以镁片、活性炭为电极,向极板上滴加食盐水后电池便可工作,电池反应为2Mg+O2+2H2O=2Mg(OH)2.下列关于该电池的说法错误的是( )| A. | 镁片作为正极 | |
| B. | 食盐水作为电解质溶液 | |
| C. | 电池工作时镁片逐渐被消耗 | |
| D. | 电池工作时实现了化学能向电能的转化 |
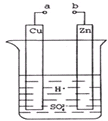 原电池是化学对人类的一个重大贡献.
原电池是化学对人类的一个重大贡献.