题目内容
7.在下列影响化学反应速率的外界因素中,肯定能使化学反应速率加快的方法是( )①升高温度 ②加入正催化剂 ③增大反应物浓度 ④将块状固体反应物磨成粉末 ⑤增大压强.
| A. | ①②③④ | B. | ①②④⑤ | C. | ①③④⑤ | D. | ①②③④⑤ |
分析 根据影响化学反应速率的因素判断,如升高温度、使用催化剂、有气体参加的反应增大压强、增大反应物浓度、增大反应物的接触面积等.
解答 解:①升高温度,加快了分子的运动速率,反应加快,故①正确;
②使用催化剂,降低了反应的活化能,活化分子百分数增大,反应速率加快,故②正确;
③增大了反应物浓度,增大了单位体积内活化分子数,反应速率加快,故③正确;
④将块状固体反应物磨成粉末,增大了反应物的接触面积,反应速率加快,故④正确;
⑤增大压强,必须有气体参加的反应,反应速率才能加快,故⑤错误;
正确的有①②③④,
故选A.
点评 本题考查了加快反应速率的因素,可以根据所学知识轻松完成,本题难度不大.

练习册系列答案
相关题目
18.现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题.
(1)已知BA5为离子化合物,写出其电子式 .
.
(2)B基态原子中能量最高的电子,其电子云在空间有3个伸展方向,原子轨道呈纺锤形.
(3)某同学根据上述信息,推断C基态原子的核外电子排布为,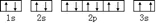 该同学所画的电子排布图违背了泡利原理.
该同学所画的电子排布图违背了泡利原理.
(4)G位于ⅦB族d区,价电子排布式为3d54s2.
(5)DE3中心原子的杂化方式为sp3.
(6)C和F的第一电离能大小关系为Mg>K(用元素符号表示)
| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能分别是: I1=738kJ/mol I2=1451kJ/mol I3=7733kJ/mol I4=10540kJ/mol |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第七列 |
 .
.(2)B基态原子中能量最高的电子,其电子云在空间有3个伸展方向,原子轨道呈纺锤形.
(3)某同学根据上述信息,推断C基态原子的核外电子排布为,
 该同学所画的电子排布图违背了泡利原理.
该同学所画的电子排布图违背了泡利原理.(4)G位于ⅦB族d区,价电子排布式为3d54s2.
(5)DE3中心原子的杂化方式为sp3.
(6)C和F的第一电离能大小关系为Mg>K(用元素符号表示)
15.据科学家预测,月球的土壤中吸附着数百万吨的${\;}_{2}^{3}$He,每百吨${\;}_{2}^{3}$He核聚变所释放出的能量相当于目前人类一年消耗的能量.在地球上氦元素主要以${\;}_{2}^{4}$He的形式存在.下列说法正确的是( )
| A. | ${\;}_{2}^{4}$He原子核内含有4个质子 | B. | ${\;}_{2}^{3}$He原子核内含有3个中子 | ||
| C. | ${\;}_{2}^{3}$He和${\;}_{2}^{4}$He互为同位素 | D. | ${\;}_{2}^{3}$He和${\;}_{2}^{4}$He互为同素异形体 |
12.下列说法正确的是( )
| A. | 离子化合物只能由金属元素和非金属元素组成 | |
| B. | 离子化合物只能存在离子键 | |
| C. | HCl能电离出氢离子和氯离子,所以HCl存在离子键 | |
| D. | 共价化合物中不可能存在离子键 |
19.下列各组物质中,互称为同分异构体的是( )
| A. | 水与冰 | B. | CH4和CH3CH3 | C. | 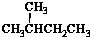 与 与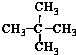 | D. | 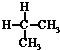 与 与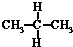 |
10.反应2SO2+O2?2SO3在密闭容器中进行.下列关于该反应的说法错误的是( )
| A. | 升高温度能加快反应速率 | B. | 使用恰当的催化剂能加快反应速率 | ||
| C. | 增大O2的浓度能加快反应速率 | D. | SO2与O2能100%转化为SO3 |
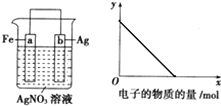 按如图装置进行实验,若x轴表示流入正极的电子的物质的量,则y轴可以表示( )
按如图装置进行实验,若x轴表示流入正极的电子的物质的量,则y轴可以表示( ) 金属冶炼和处理常涉及氧化还原反应.
金属冶炼和处理常涉及氧化还原反应.