题目内容
6.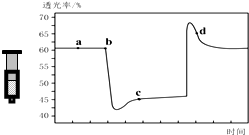 已知反应:2NO2 (红棕色)?N2O4(无色)△H<0.将一定量的NO2充入注射器中后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小).下列说法正确的是( )
已知反应:2NO2 (红棕色)?N2O4(无色)△H<0.将一定量的NO2充入注射器中后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小).下列说法正确的是( )| A. | b点的操作是压缩注射器 | |
| B. | c点与a点相比,c(NO2)增大,c(N2O4)减小 | |
| C. | d 点:v(正)>v(逆) | |
| D. | 若不忽略体系温度变化,且没有能量损失,则T(b)>T(c) |
分析 该反应是正反应气体体积减小的放热反应,压强增大平衡虽正向移动,但二氧化氮浓度增大,混合气体颜色变深,压强减小平衡逆向移动,但二氧化氮浓度减小,混合气体颜色变浅,据图分析,b点开始是压缩注射器的过程,气体颜色变深,透光率变小,c点后的拐点是拉伸注射器的过程,气体颜色变浅,透光率增大,据此分析.
解答 解:A、b点开始是压缩注射器的过程,气体颜色变深,透光率变小,故A正确;
B、c点是压缩注射器后的情况,二氧化氮和四氧化二氮的浓度都增大,故B错误;
C、c点后的拐点是拉伸注射器的过程,d点是平衡向气体体积增大的逆向移动过程,所以v(逆)>v(正),故C错误;
D、b点开始是压缩注射器的过程,平衡正向移动,反应放热,导致T(b)<T(c),故D错误;
故选A.
点评 本题通过图象和透光率考查了压强对平衡移动的影响,注意勒夏特列原理的应用,题目难度不大.

练习册系列答案
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案
相关题目
16.设NA代表阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 标准状况下22.4LH20中共价键总数为2NA | |
| B. | 32gO3中含有NA个氧原子 | |
| C. | 向装有催化剂的密闭容器加入1molN2和3 mol H2,充分反应后得2NA个NH3分子 | |
| D. | 1.8g的NH4+中含有电子的物质的量为1mol |
1.下列物质的性质与应用对应关系不正确的是( )
| A. | 亚硫酸钠有还原性,可用作脱氧剂 | B. | FeCl3有氧化性,可用于制印刷电路 | ||
| C. | 铝有还原性,可冶炼某些金属 | D. | 浓硫酸有吸水性,可用于干燥氨气 |
11.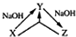 化学之“化”,体现在物质之间的相互转化,用X表示下列物质,其中在溶液中不可能实现如图转化关系的是( )
化学之“化”,体现在物质之间的相互转化,用X表示下列物质,其中在溶液中不可能实现如图转化关系的是( )
 化学之“化”,体现在物质之间的相互转化,用X表示下列物质,其中在溶液中不可能实现如图转化关系的是( )
化学之“化”,体现在物质之间的相互转化,用X表示下列物质,其中在溶液中不可能实现如图转化关系的是( )| A. | AlCl3 | B. | CO2 | C. | SiO2 | D. | H2S |
18.推理是一种重要的思维方法.下列推理合理的是( )
| A. | 浓硫酸具有吸水性,能干燥氢气,也能干燥氨气 | |
| B. | 乙醛具有还原性,能被新制氢氧化铜浊液氧化,也能被溴水氧化 | |
| C. | SO2具有漂白性,能使品红褪色,也能使酸性KMnO4溶液褪色 | |
| D. | 硝酸属于强酸,能与CaCO3反应生成CO2气体,也能与CaSO3生成SO2 |
15.下列各组物质的性质,从左到右依次递减的是( )
| A. | 碱性:Al(OH)3、Mg(OH)2、NaOH | B. | 还原性:HCl、HBr、HI | ||
| C. | 酸性:HClO4、H2SO4、H3PO4 | D. | 稳定性:HI、HBr、HCl |
16.下列离子方程式中书写不正确的是( )
| A. | 少量二氧化硫与苛性钠溶液反应:SO2+2OH-=SO32-+H2O | |
| B. | 过量稀盐酸加入纯碱中:CO32-+2H+=H2O+CO2↑ | |
| C. | 铜粉与稀硫酸溶液反应:Cu+2H+=Cu2++H2↑ | |
| D. | 在氯化铝溶液中滴加过量的氨水:Al3++3NH3•H2O=Al(OH)3↓+3NH4+ |


 ,它的分子中含有4种不同化学环境的氢原子.
,它的分子中含有4种不同化学环境的氢原子. $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +H2O.
+H2O. .
.