题目内容
17.有机物J(分子式为C20H18O4)是一种果味香精的主要成分,可用A、B两种天然有机物为基础原料按如图表示路径合成(某些步骤所需无机试剂和反应条件未标出):
其中:A是酒类的主要成分,也可以加入汽油中作为新型燃料;B是最简单的芳香醛,广泛存在于苦杏仁中,在食品行业常作为辛香味料添加剂.
已知两个醛分子间能发生如下反应(其中-R、-R′表示烃基或氢原子):

试回答下列问题:
(1)反应①的条件是浓硫酸、170℃;反应⑧的类型是酯化反应.
(2)B的结构简式是
 ,它的分子中含有4种不同化学环境的氢原子.
,它的分子中含有4种不同化学环境的氢原子.(3)Ⅰ的分子中所含官能团的名称是羧基、碳碳双键.
反应③:BrCH2CH2Br+2NaOH$→_{△}^{水}$HOCH2CH2OH+2NaBr;
反应⑥:
 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +H2O.
+H2O.(5)某有机物K是G的同分异构体,同时满足下列条件的K的结构共有18种(不考虑立体异构).
Ⅰ.能与FeCl3溶液发生显色反应;
Ⅱ.能与溴的四氧化碳溶液发生加成反应;
Ⅲ.苯环上有三个取代基,且有两个取代基完全相同.
其中一种K的结构中,三个取代基均处于苯环间位上,且其中一个取代基上有支链,其结构简式为
 .
.
分析 A是酒类的主要成分,也可以加入汽油中作为新型燃料,则A为CH3CH2OH,B是最简单的芳香醛,则B为 ,由反应信息及反应⑤条件可知,F含有醛基,故反应④为乙醇发生催化氧化生成F为CH3CHO,则G为
,由反应信息及反应⑤条件可知,F含有醛基,故反应④为乙醇发生催化氧化生成F为CH3CHO,则G为 ,G发生消去反应生成H为
,G发生消去反应生成H为 ,H发生银镜反应、酸化得到I为
,H发生银镜反应、酸化得到I为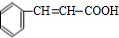 .有机物J(分子式为C20H18O4)是一种果味香精的主要成分,应属于酯类物质,结合转化关系可知,乙醇在浓硫酸、加热条件下发生消去反应生成C为CH2=CH2,乙烯与溴发生加成反应生成D为BrCH2CH2Br,D在氢氧化钠水溶液、加热条件下发生水解反应生成E为HOCH2CH2OH,结合J的分子式可知,1分子E与2分子I发生酯化反应得到J,故J的结构简式为:
.有机物J(分子式为C20H18O4)是一种果味香精的主要成分,应属于酯类物质,结合转化关系可知,乙醇在浓硫酸、加热条件下发生消去反应生成C为CH2=CH2,乙烯与溴发生加成反应生成D为BrCH2CH2Br,D在氢氧化钠水溶液、加热条件下发生水解反应生成E为HOCH2CH2OH,结合J的分子式可知,1分子E与2分子I发生酯化反应得到J,故J的结构简式为: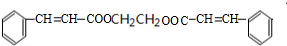 ,据此解答.
,据此解答.
解答 解:A是酒类的主要成分,也可以加入汽油中作为新型燃料,则A为CH3CH2OH,B是最简单的芳香醛,则B为 ,由反应信息及反应⑤条件可知,F含有醛基,故反应④为乙醇发生催化氧化生成F为CH3CHO,则G为
,由反应信息及反应⑤条件可知,F含有醛基,故反应④为乙醇发生催化氧化生成F为CH3CHO,则G为 ,G发生消去反应生成H为
,G发生消去反应生成H为 ,H发生银镜反应、酸化得到I为
,H发生银镜反应、酸化得到I为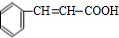 .有机物J(分子式为C20H18O4)是一种果味香精的主要成分,应属于酯类物质,结合转化关系可知,乙醇在浓硫酸、加热条件下发生消去反应生成C为CH2=CH2,乙烯与溴发生加成反应生成D为BrCH2CH2Br,D在氢氧化钠水溶液、加热条件下发生水解反应生成E为HOCH2CH2OH,结合J的分子式可知,1分子E与2分子I发生酯化反应得到J,故J的结构简式为:
.有机物J(分子式为C20H18O4)是一种果味香精的主要成分,应属于酯类物质,结合转化关系可知,乙醇在浓硫酸、加热条件下发生消去反应生成C为CH2=CH2,乙烯与溴发生加成反应生成D为BrCH2CH2Br,D在氢氧化钠水溶液、加热条件下发生水解反应生成E为HOCH2CH2OH,结合J的分子式可知,1分子E与2分子I发生酯化反应得到J,故J的结构简式为: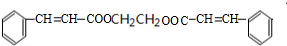 .
.
(1)反应①是乙醇发生消去反应生成乙烯,反应的条件是:浓硫酸、170℃;反应⑧的类型是:酯化反应,
故答案为:浓硫酸、170℃;酯化反应;
(2)B的结构简式是 ,它的分子中含有4种不同化学环境的氢原子,
,它的分子中含有4种不同化学环境的氢原子,
故答案为: ;4;
;4;
(3)I为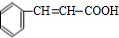 ,分子中所含官能团的名称是:羧基、碳碳双键,
,分子中所含官能团的名称是:羧基、碳碳双键,
反应③的化学方程式为:BrCH2CH2Br+2NaOH$→_{△}^{水}$HOCH2CH2OH+2NaBr,
反应⑥的化学方程式为: $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +H2O,
+H2O,
故答案为:羧基、碳碳双键;BrCH2CH2Br+2NaOH$→_{△}^{水}$HOCH2CH2OH+2NaBr; $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +H2O;
+H2O;
(5)某有机物K是G( )的同分异构体,同时满足下列条件:
)的同分异构体,同时满足下列条件:
Ⅰ.能与FeCl3溶液发生显色反应,说明含有酚羟基,
Ⅱ.能与溴的四氧化碳溶液发生加成反应,含有碳碳双键;
Ⅲ.苯环上有三个取代基,且有两个取代基完全相同,含有2个-OH、另外取代基为-CH=CHCH3或-CH2CH=CH2或-C(CH3)=CH2,2个羟基有邻、间、对3种位置,对应的另一个取代基分别有2、3、1种位置,故符合条件的同分异构体有(2+3+1)×3=18种,
其中一种K的结构中,三个取代基均处于苯环间位上,且其中一个取代基上有支链,其结构简式为 ,
,
故答案为:18; .
.
点评 本题考查有机物的推断,需要学生对给予的信息进行利用,较好的考查学生自学能力、分析推理能力,明确A与B的结构是推断关键,再结合J的分子式、反应条件进行推断,需要学生熟练掌握官能团的性质与转化,(5)中同分异构体数目判断为易错点,注意利用定二移一法判断,难度中等.

| A. | 用氨水鉴别Al3+、Mg2+和Ag+ | |
| B. | 用盐酸、BaCl2溶液鉴别Cl-、SO42-和CO32- | |
| C. | 用溴水鉴别CH4和C2H4 | |
| D. | 用KMnO4酸性溶液鉴别CH3CH2OH和CH3CHO |
| A. | Cr | B. | ds 区元素 | C. | ⅡA族元素 | D. | ⅦB族元素 |
| A. | 10个 | B. | 14个 | C. | 18个 | D. | 24个 |
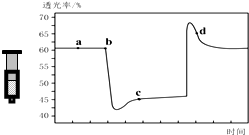 已知反应:2NO2 (红棕色)?N2O4(无色)△H<0.将一定量的NO2充入注射器中后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小).下列说法正确的是( )
已知反应:2NO2 (红棕色)?N2O4(无色)△H<0.将一定量的NO2充入注射器中后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小).下列说法正确的是( )| A. | b点的操作是压缩注射器 | |
| B. | c点与a点相比,c(NO2)增大,c(N2O4)减小 | |
| C. | d 点:v(正)>v(逆) | |
| D. | 若不忽略体系温度变化,且没有能量损失,则T(b)>T(c) |
| A. | pH=3的二元弱酸H2R溶液与 pH=11的NaOH溶液混合后,混合液的pH等于7,则混合液中c(R2-)>c(Na+)>c(HR-) | |
| B. | 将0.2 mol/L的某一元弱酸HA溶液和0.1mol/L NaOH溶液等体积混合后溶液中存在:2c(OH-)+c(A-)=2c(H+)+c(HA) | |
| C. | 某物质的水溶液中由水电离出的c(H+)=1×10-amol/L,若a>7,则该溶液的pH为a或14-a | |
| D. | 相同温度下,0.2mol/L的醋酸溶液与0.1mol/L的醋酸溶液中c(H+)之比小于2:1 |
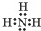 ;NH3在同族元素形成的氢化物中具有较高的沸点,其原因是NH3分子间有氢键.
;NH3在同族元素形成的氢化物中具有较高的沸点,其原因是NH3分子间有氢键.
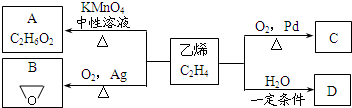 乙烯有如下转化关系.乙烯在不同的条件下可被氧化成不同产物,如A、B、C.已知:取0.01mol A与足量的钠完全反应后,生成224mL(标准状况)气体.C是B的同分异构体,C与新制的氢氧化铜浊液一起加热,会产生红色沉淀.
乙烯有如下转化关系.乙烯在不同的条件下可被氧化成不同产物,如A、B、C.已知:取0.01mol A与足量的钠完全反应后,生成224mL(标准状况)气体.C是B的同分异构体,C与新制的氢氧化铜浊液一起加热,会产生红色沉淀.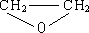 +H2O$\stackrel{一定条件}{→}$
+H2O$\stackrel{一定条件}{→}$ .
.