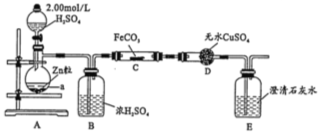
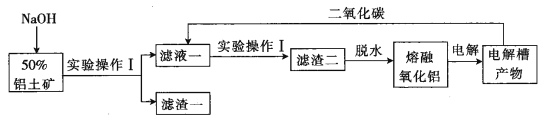
��Ŀ����
����Ŀ��ij�¶�ʱ����2 L�ܱ������У�������̬����X��Y��Z�����ʵ�����n����ʱ�䣨t���仯��������ͼ��ʾ����ͼ�����ݷ����ɵã�
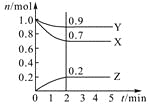
��1���÷�Ӧ�Ļ�ѧ����ʽΪ ��
��2����Ӧ��ʼ��2 min����Y��ʾ��ƽ����Ӧ����Ϊ ��X��ת����Ϊ ��
��3����һ���¶��£������������Ϊ������Ӧ�ﵽ��Ӧ�ȵı�־���� ��
A��X��Y��Z��Ũ����� |
B��X��Y��Z�ķ�������Ϊ3�U1�U2 |
C��Z������������Y���������ʵĶ��� |
D����λʱ��������n mol Y��ͬʱ����3n mol X |
��4�����ܱ������ͨ��a mol A��g����b mol B��g����
������ӦA��g��+ B��g��= 2C��g�������ı���������ʱ����ӿ췴Ӧ���ʵ��� ������ţ���
�������¶�
������������������䣬���뺤��
���������
������������������䣬����A��g�������ʵ���
���𰸡���1��3X+Y![]() 2Z����2��0.025mol/(L��min)��30%����3��C����4���ۢ���
2Z����2��0.025mol/(L��min)��30%����3��C����4���ۢ���
�������������������1��X��Y���ʵ�����С������Ӧ�Z���ʵ����������������ѧ��Ӧ����֮��=��ѧ������֮�ȣ���Ϊ��ʱ��������������ʵ���֮�ȵ��ڻ�ѧ������֮�ȣ�X��Y��Z=(1��0.7)��(1��0.9)��0.2=3��1��2�� 3X+Y![]() 2Z����2�����ݻ�ѧ��Ӧ���ʵ���ѧ����ʽ��v(Y)=(1��0.9)/(2��2)mol/(L��min)="0.025" mol/(L��min)��X��ת����=(1��0.7)/1��100%=30%����3��A�����ݻ�ѧƽ��״̬���壬����ֵ�Ũ�Ȳ��ٸı䣬˵���ﵽƽ�⣬�ʴ���B��û��ָ����Ӧ�������жϵ�ƽ�⣬�ʴ���C����ͬ���ʵķ�Ӧ�����жϴﵽƽ�⣬Ҫ��һ��һ�棬�ҷ�Ӧ����֮�ȵ���ϵ��֮�ȣ�����ȷ��D����Ӧ�������淴Ӧ���ʴ���4���������¶ȣ���ѧ��Ӧ���ʼ������ʴ��������ݣ�����Ƿ�Ӧ���壬����ֵ�Ũ�Ȳ��䣬��ѧ��Ӧ���ʲ��䣬�ʴ���������������ӿ췴Ӧ���ʣ�����ȷ��������A�����ʵ���������Ӧ���Ũ�ȣ��ӿ췴Ӧ���ʣ�����ȷ��
2Z����2�����ݻ�ѧ��Ӧ���ʵ���ѧ����ʽ��v(Y)=(1��0.9)/(2��2)mol/(L��min)="0.025" mol/(L��min)��X��ת����=(1��0.7)/1��100%=30%����3��A�����ݻ�ѧƽ��״̬���壬����ֵ�Ũ�Ȳ��ٸı䣬˵���ﵽƽ�⣬�ʴ���B��û��ָ����Ӧ�������жϵ�ƽ�⣬�ʴ���C����ͬ���ʵķ�Ӧ�����жϴﵽƽ�⣬Ҫ��һ��һ�棬�ҷ�Ӧ����֮�ȵ���ϵ��֮�ȣ�����ȷ��D����Ӧ�������淴Ӧ���ʴ���4���������¶ȣ���ѧ��Ӧ���ʼ������ʴ��������ݣ�����Ƿ�Ӧ���壬����ֵ�Ũ�Ȳ��䣬��ѧ��Ӧ���ʲ��䣬�ʴ���������������ӿ췴Ӧ���ʣ�����ȷ��������A�����ʵ���������Ӧ���Ũ�ȣ��ӿ췴Ӧ���ʣ�����ȷ��