题目内容
【题目】下面是工业利用铝土矿(含杂质SiO2、Fe2O3)制取铝的工艺流程,回答有关问题:
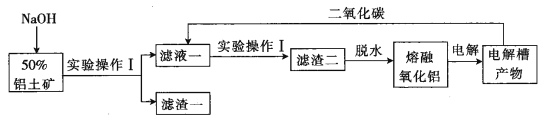
(1)铝土矿磨碎化浆,利用胶体粒子的性质,通入直流电除去_________,制得50%铝土矿。
(2)操作I的名称是__________,实验室进行此操作所需玻璃仪器为____________。
(3)加入NaOH所发生的离子反应方程式为_____________,滤渣一为___________(填化学式)。
(4)电解槽用石墨作阳极,生成二氧化碳的原因是______________。
【答案】(1)SiO2;
(2)过滤,烧杯、玻璃棒和漏斗;
(3)Al2O3+2OH-=2AlO2-+H2O Fe2O3;
(4)高温下电解池阳极产生氧气,氧气与石墨生成二氧化碳
【解析】
试题分析:(1)铝土矿磨碎化浆,金属氧化物与非金属氧化物所带电荷不同,利用胶体粒子的性质,通入直流电除去SiO2,制得50%铝土矿;(2)操作I把固体与液体分离,名称是过滤;实验室进行此操作所需玻璃仪器为烧杯、玻璃棒和漏斗;(3)50%的铝土矿的成分是氧化铁和氧化铝,氧化铁与氢氧化钠不反应,加入NaOH所发生的离子反应方程式为Al2O3+2OH-=2AlO2-+H2O,滤渣一为Fe2O3;(4)电解槽用石墨作阳极,电解方程式为2Al2O3 (熔融)![]() 4Al+3O2↑,高温下电解池阳极产生氧气,氧气与石墨生成二氧化碳。
4Al+3O2↑,高温下电解池阳极产生氧气,氧气与石墨生成二氧化碳。

【题目】某温度时,在2 L密闭容器中,三种气态物质X、Y、Z的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据分析可得:
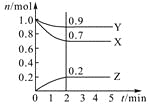
(1)该反应的化学方程式为 。
(2)反应开始至2 min,用Y表示的平均反应速率为 ,X的转化率为 。
(3)在一定温度下,下列情况可作为上述反应达到反应限度的标志的是 。
A.X、Y、Z的浓度相等 |
B.X、Y、Z的分子数比为3︰1︰2 |
C.Z的生成速率是Y的生成速率的二倍 |
D.单位时间内生成n mol Y,同时生成3n mol X |
(4)在密闭容器里,通入a mol A(g)和b mol B(g),
发生反应A(g)+ B(g)= 2C(g),当改变下列条件时,会加快反应速率的是 (填序号)。
①降低温度
②保持容器的体积不变,充入氦气
③加入催化剂
④保持容器的体积不变,增加A(g)的物质的量