题目内容
11.氯碱厂电解饱和食盐水制取NaOH溶液的工艺流程如下图所示,完成下列填空: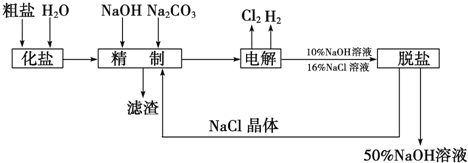
(1)在电解过程中,与电源负极相连的电极上的电极反应式为2H++2e-=H2↑,若检验与电源正极相连的电极上的气体产物,实验室中通常选用的化学试剂是淀粉、碘化钾.
(2)工业食盐中含Ca2+、Mg2+等杂质,精制过程发生反应的离子方程式为Ca2++CO32-=CaCO3↓、Mg2++2OH-=Mg(OH)2↓.
(3)如果粗盐中SO42-含量较高,必须添加钡试剂除去,该钡试剂可以是ac(选填a、b、c).
a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2
(4)为了有效地除去Ca2+、Mg2+、SO42-,加入试剂的合理顺序为bc(选填a、b、c).
a.先加NaOH,后加Na2CO3,再加钡试剂
b.先加NaOH,后加钡试剂,再加Na2CO3
c.先加钡试剂,后加NaOH,再加Na2CO3
(5)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过加热蒸发、冷却、过滤(填写操作名称)除去NaCl.
分析 (1)在电解过程中,是电解饱和食盐水,与电源负极相连的电极上的电极反应是溶液中氢离子得到电子生成氢气的反应,与电源正极相连的电极上的气体产物为溶液中氯离子失电子生成的氯气,可以用湿润的淀粉碘化钾试纸检验氯气的存在;
(2)工业食盐中含Ca2+、Mg2+等杂质,精制过程发生反应为加入氢氧化钠除去镁离子,加入碳酸钠除去钙离子;
(3)除杂的要求一般所加试剂最好是不引进新的杂质离子.
(4)根据除去钙离子用碳酸根离子进行沉淀,除去镁离子用氢氧根离子进行沉淀,除去硫酸根离子用钡离子沉淀,过量的钡离子需要用碳酸根离子除去进行分析.
(5)根据氯化钠的溶解度随温度变化不大的特征进行分析,固体和液体分离用过滤操作;
解答 解:(1)在电解过程中,是电解饱和食盐水,与电源负极相连的电极上的电极反应是溶液中氢离子得到电子生成氢气的反应,与电源正极相连的电极上的气体产物为溶液中氯离子失电子生成的氯气,可以用湿润的淀粉碘化钾试纸检验氯气的存在,需要的试剂为淀粉、碘化钾;
故答案为:2H++2e-=H2↑,淀粉、碘化钾;
(2)工业食盐中含Ca2+、Mg2+等杂质,精制过程发生反应为加入氢氧化钠除去镁离子,离子方程式为:Mg2++2OH-=Mg(OH)2↓;加入碳酸钠除去钙离子;
离子方程式为:Ca2++CO32-=CaCO3↓;
故答案为:Ca2++CO32-=CaCO3↓、Mg2++2OH-=Mg(OH)2↓;
(3)如选用b选项的Ba(NO3)2,会引入硝酸根,很难除去,所以b选项不正确.
故选ac,
故答案为:ac;
(4)根据除去钙离子用碳酸根离子进行沉淀,除去镁离子用氢氧根离子进行沉淀,除去硫酸根离子用钡离子沉淀,过量的钡离子需要用碳酸根离子除去,加入加入Na2CO3的顺序必须在加入钡离子的后面即可,分析选项可知bc三符合题意.
故答案为:bc.
(5)因为氯化钠的溶解度随温度变化不大,所以可以采用蒸发溶剂法结晶,除去氢氧化钠中的氯化钠,分离固体和液体的实验操作为过滤,
故答案为:加热蒸发,过滤.
点评 本题是一道综合性试题,涉及知识点比较多,要求学生有完整的知识结构和分析问题的能力,题目难度中等.

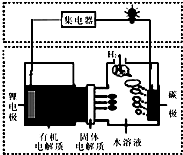
| A. | 碳极发生的反应是:2H2O+O2+4e-═4OH- | |
| B. | 有机电解质通过固体电解质可进入水溶液中 | |
| C. | 理论上,外电路中每转移1mol电子,负极消耗的质量为7g | |
| D. | 该电池如可以充电,充电时碳极接外加电源的负极,锂极接外加电池的正极 |
| A. | 将NaHCO3固体加入新制氯水,有无色气泡(H+) | |
| B. | 氯水可以导电(Cl2) | |
| C. | 向FeCl2溶液中滴加氯水,再滴加KSCN溶液,发现呈血红色(Cl2) | |
| D. | 滴加AgNO3溶液生成白色沉淀(Cl-) |
| A. | 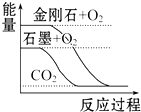 石墨转变为金刚石是吸热反应 | |
| B. | 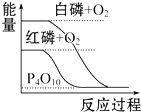 白磷比红磷稳定 | |
| C. | 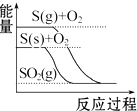 S(g)+O2(g)═SO2(g)△H1 S(s)+O2(g)═SO2(g)△H2 则△H1>△H2 | |
| D. | 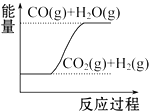 CO(g)+H2O(g)═CO2(g)+H2(g)△H1>0 |
| A. | 钢化玻璃 | B. | 漂白粉 | C. | 消石灰 | D. | 水玻璃 |
| A. | 原子半径:Y>Z>R>T | |
| B. | XR2、WR2两化合物中R的化合价相同 | |
| C. | 最高价氧化物对应的水化物碱性:X>Z | |
| D. | 气态氢化物的稳定性:W<R<T |
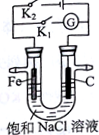 如图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中.下列叙述正确的是( )
如图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中.下列叙述正确的是( )| A. | K1闭合,向铁棒附近滴入K3[Fe(CN)6]溶液,有蓝色沉淀出现 | |
| B. | K1闭合,电流方向由铁棒经导线流向石墨棒 | |
| C. | K2闭合,碳棒是阴极 | |
| D. | K2闭合,电路中通过0.2NA个电子时,两极共产生4.48L气体 |
| A. | Cl2作氧化剂,发生还原反应 | |
| B. | 钾元素化合价降低 | |
| C. | 该反应是置换反应 | |
| D. | 每生成2 mol K2FeO4,转移3 mol电子 |
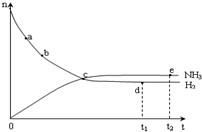 合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g),673K、30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )
合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g),673K、30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )| A. | 点a的正反应速率比点b的大 | |
| B. | 点c处反应达到平衡 | |
| C. | 点d(t1时刻) 和点e(t2时刻)处n(N2)不一样 | |
| D. | 点d正反应速率和点 e的逆反应速率一样 |