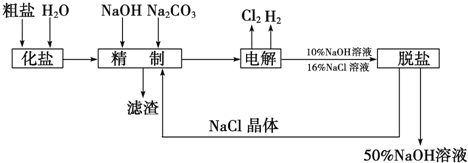
题目内容
6.下列物质具有固定熔沸点的是( )| A. | 钢化玻璃 | B. | 漂白粉 | C. | 消石灰 | D. | 水玻璃 |
分析 有固定的熔点、沸点的物质一定是纯净物,混合物无固定的熔沸点,据此判断.
解答 解:A、钢化玻璃就是将普通退火玻璃先切割成要求尺寸,然后加热到接近软化点的700度左右,再进行快速均匀的冷却而得到的玻璃,属于混合物,无固定的熔沸点,故A错误;
B、漂白粉主要成分是次氯酸钙,还混有氯化钙,属于混合物,无固定的熔沸点,故B错误;
C、消石灰为氢氧化钙,属于纯净物,故C正确;
D、水玻璃为硅酸钠的水溶液,为混合物,无固定的熔沸点,故D错误,故选C.
点评 本题考查混合物的性质,难度不大,根据物质没有固定的沸点判断物质为一定是混合物是解题关键.

练习册系列答案
相关题目
16.下列事实能说明某物质是强电解质的是( )
| A. | 该物质在水中的溶解度大 | |
| B. | 该物质的水溶液导电能力强 | |
| C. | 该物质的水溶液中不存在溶质分子 | |
| D. | 该物质的水溶液中不存在除水外的电离平衡 |
17.能正确表示下列反应的离子方程式是( )
| A. | Fe3O4溶于足量稀HNO3:Fe3O4+8H+═Fe2++2Fe3++4H2O | |
| B. | NH4HCO3溶液与足量Ba(OH)2溶液混合:HCO3-+Ba2++OH-═BaCO3↓+H2O | |
| C. | 向澄清石灰水中通入过量CO2:OH-+CO2═HCO3- | |
| D. | 将0.1mol/L的NH4Al(SO4)2溶液与0.3mol/L的Ba(OH)2溶液等体积混合:2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ |
14.如图所示:2个甲分子反应生成1个丙分子和3个乙分子,对此下列判断不正确的是( )

| A. | 1个乙分子中含有3个A原子 | B. | 该反应类型是分解反应 | ||
| C. | 反应生成的丙物质属于单质 | D. | 化学反应中分子的种类发生了改变 |
1.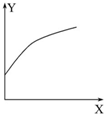 在密闭的容积可变的容器中通入A、B两种气体,在一定条件下反应:2A(g)+B(g)?2C(g)△H<0.达到平衡后,改变一个条件,下列量(Y)的变化不符合图中曲线的是( )
在密闭的容积可变的容器中通入A、B两种气体,在一定条件下反应:2A(g)+B(g)?2C(g)△H<0.达到平衡后,改变一个条件,下列量(Y)的变化不符合图中曲线的是( )
 在密闭的容积可变的容器中通入A、B两种气体,在一定条件下反应:2A(g)+B(g)?2C(g)△H<0.达到平衡后,改变一个条件,下列量(Y)的变化不符合图中曲线的是( )
在密闭的容积可变的容器中通入A、B两种气体,在一定条件下反应:2A(g)+B(g)?2C(g)△H<0.达到平衡后,改变一个条件,下列量(Y)的变化不符合图中曲线的是( )| X | Y | |
| A | 再加入A | B的转化率 |
| B | 降低温度 | 混合气体的密度 |
| C | 增大压强 | A的转化率 |
| D | 升高温度 | 混合气体的平均摩尔质量 |
| A. | A | B. | B | C. | C | D. | D |
18.碱性电池具有容量大、放电电流大的特点,因而得到广泛应用.锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)═Zn(OH)2(s)+Mn2O3(s).则下列说法正确的是( )
| A. | .电池工作时,MnO2发生还原反应 | |
| B. | .电池负极的电极反应式为:2MnO2+H2O+2e-→Mn2O3+2OH- | |
| C. | .电池工作时,电路中每通过0.2mol电子,锌的质量理论上减少6.5g | |
| D. | 电池工作时,K+移向负极 |
15.设NA 表示阿伏加德罗常数的值.下列说法正确的是( )
| A. | 0.1 mol 甲基(-CH3)中含有的电子总数为NA | |
| B. | 标准状况下,11.2 L乙醇所含碳原子数目为NA | |
| C. | 常温常压下,26 g 苯中所含的碳碳双键数为NA | |
| D. | 23g钠在足量氧气充分燃烧,转移电子数为NA |
16.欲除去下列各物质中的少量杂质,括号内试剂选择正确的是( )
| A. | 溴苯中的溴(KI溶液) | B. | 溴乙烷中的乙醇(水) | ||
| C. | 苯中的苯酚(溴水) | D. | 乙酸乙酯中的乙酸(饱和Na2CO3溶液) |