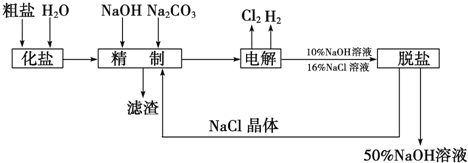
题目内容
1.近几年科学家发明的一种新型可控电池--锂水电池,工作原理如图所示.下列有关说法正确的是( )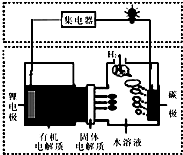
| A. | 碳极发生的反应是:2H2O+O2+4e-═4OH- | |
| B. | 有机电解质通过固体电解质可进入水溶液中 | |
| C. | 理论上,外电路中每转移1mol电子,负极消耗的质量为7g | |
| D. | 该电池如可以充电,充电时碳极接外加电源的负极,锂极接外加电池的正极 |
分析 因锂与水反应,则形成原电池时锂为负极,碳为正极,且负极不能与水接触,负极反应为Li-e-=Li+,正极反应为2H2O+2e-=H2↑+2OH-,结合电极方程式解答该题.
解答 解:A.反应中水为氧化剂,氧气不参加反应,正极方程式为2H2O+2e-=H2↑+2OH-,故A错误;
B.由于金属Li可以和水之间反应生成氢氧化锂和氢气,但是和有机电解质不反应,所以有机电解质通过固体电解质不可进入水溶液中,故B错误;
C.理论上,外电路中每转移1mol电子,由Li-e-=Li+可知消耗1moLi,质量为7g,故C正确;
D.充电时,锂电极发生还原反应生成Li,应连接电源负极,故D错误.
故选C.
点评 本题考查新型电池,为高频考点,侧重于学生的分析能力的考查,题目难度不大,解答本题的关键是根据物质的性质判断电极反应,并能书写有关反应的离子方程式.

练习册系列答案
 学习实践园地系列答案
学习实践园地系列答案
相关题目
11.NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 常温下,78g Na202中含有的阴离子数为2NA | |
| B. | 常温下,1L 0.1 mol/L NH4NO3溶液中含有的NH4 +数为0.1NA | |
| C. | 标准状况下,22.4 L己烷中含有的共价键的数目为19 NA | |
| D. | 30 g SiO2晶体中含有Si-O键的数目为2 Na |
9.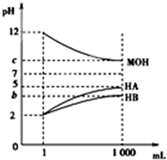 室温下,将pH=2的两种酸溶液HA、HB和pH=12的碱溶液MOH各1mL,分别加水稀释到1 000mL,其pH的变化与溶液体积的关系如图,下列说法错误的是( )
室温下,将pH=2的两种酸溶液HA、HB和pH=12的碱溶液MOH各1mL,分别加水稀释到1 000mL,其pH的变化与溶液体积的关系如图,下列说法错误的是( )
 室温下,将pH=2的两种酸溶液HA、HB和pH=12的碱溶液MOH各1mL,分别加水稀释到1 000mL,其pH的变化与溶液体积的关系如图,下列说法错误的是( )
室温下,将pH=2的两种酸溶液HA、HB和pH=12的碱溶液MOH各1mL,分别加水稀释到1 000mL,其pH的变化与溶液体积的关系如图,下列说法错误的是( )| A. | HA为强酸,HB为弱酸 | |
| B. | 若b+c=14,则MOH为弱碱 | |
| C. | 若c=9,则稀释后的三种溶液中,由水电离的氢离子的浓度的大小顺序为HA>MOH>HB | |
| D. | 若c=9,将稀释后的HA溶液和MOH溶液取等体积混合,则所得溶液中c(A-)=c(M+) |
16.下列事实能说明某物质是强电解质的是( )
| A. | 该物质在水中的溶解度大 | |
| B. | 该物质的水溶液导电能力强 | |
| C. | 该物质的水溶液中不存在溶质分子 | |
| D. | 该物质的水溶液中不存在除水外的电离平衡 |
13.有机物的种类繁多,但其命名是有规则的.下列有机物命名正确的是( )
| A. | CH3CH(CH2CH3)CH2CH3 2-乙基丁烷 | B. | CH2CHBr2 二氯乙烷 | ||
| C. | CH3CH(CH3)CH=CH2 2-甲基丁烯 | D. | 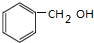 苯甲醇 苯甲醇 |
10.某有机物A可用于合成药物达菲,其结构简式如图,下列关于A的说法不正确的是( )


| A. | 分子式为C7H6O5 | |
| B. | 和溴水既可以发生取代反应,又可以发生加成反应 | |
| C. | 1 mol该化合物最多可以与含4 mol NaOH的溶液反应 | |
| D. | 既可以和FeCl3溶液发生显色反应,又可以和NaHCO3溶液反应放出CO2气体 |
 将纯锌片和纯铜片按如图方式插入100mL相同浓度的稀硫酸中一段时间,回答下列问题:
将纯锌片和纯铜片按如图方式插入100mL相同浓度的稀硫酸中一段时间,回答下列问题: Ⅰ.铬位于第四周期ⅥB族,主要化合价+2,+3,+6,单质硬度大,耐腐蚀,是重要的合金材料.
Ⅰ.铬位于第四周期ⅥB族,主要化合价+2,+3,+6,单质硬度大,耐腐蚀,是重要的合金材料. ,CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断CrO2Cl2是非极性(填“极性”或“非极性”)分子.
,CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断CrO2Cl2是非极性(填“极性”或“非极性”)分子.