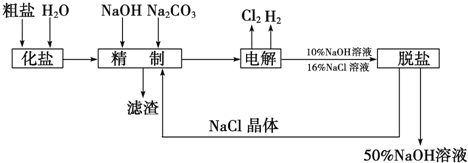
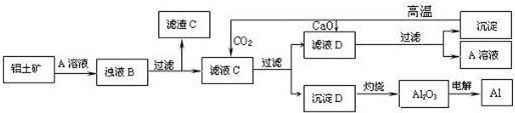
题目内容
1.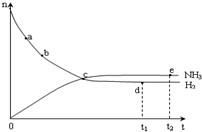 合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g),673K、30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )
合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g),673K、30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )| A. | 点a的正反应速率比点b的大 | |
| B. | 点c处反应达到平衡 | |
| C. | 点d(t1时刻) 和点e(t2时刻)处n(N2)不一样 | |
| D. | 点d正反应速率和点 e的逆反应速率一样 |
分析 A.物质的物质的量越大,其反应速率越大;
B.正逆反应速率相等时,可逆反应达到平衡状态,反应体系中各物质的物质的量不变、物质的量浓度不变、百分含量不变;
C.平衡状态时各物质的物质的量不变;
D.达到平衡状态时,各物质的反应速率之比等于其计量数之比.
解答 解:A.物质的物质的量越大,其反应速率越大,a的物质的量大于b点,所以点a的正反应速率比点b的大,故A正确;
B.c处氨气和氢气的物质的量相等,但随着时间的变化,二者的物质的量发生变化,说明c点没有达到平衡状态,故B错误;
C.平衡状态时各物质的物质的量不变,de处氨气、氢气的物质的量不变,说明达到平衡状态,则点d(t1时刻) 和点e(t2时刻)处n(N2)一样,故C错误;
D.达到平衡状态时,各物质的反应速率之比等于其计量数之比,de处为平衡状态,氢气正反应速率与氨气逆反应速率之比为3:2,故D错误;
故选A.
点评 本题考查图象分析,侧重考查学生分析判断能力,涉及平衡状态判断、物质的量与反应速率的关系等知识点,易错选项是D,用不同物质表示同一可逆反应的反应速率其反应速率可能不同,题目难度不大.

练习册系列答案
 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案
相关题目
12.已知鲨烯分子含有30个C原子及6个C=C且不含环状结构,则其分子式为( )
| A. | C30H50 | B. | C30H52 | C. | C30H56 | D. | C30H60 |
9.下列化合物在1H-NMR中出现三组特征峰的是( )
| A. | 2一甲基一2一丁烯 | B. | 3,3一二甲基一2一丁醇 | ||
| C. | 4一甲基苯酚 | D. | 2,3,4一三甲基戊烷 |
16.欲除去下列各物质中的少量杂质,括号内试剂选择正确的是( )
| A. | 溴苯中的溴(KI溶液) | B. | 溴乙烷中的乙醇(水) | ||
| C. | 苯中的苯酚(溴水) | D. | 乙酸乙酯中的乙酸(饱和Na2CO3溶液) |
6.(1)下表是在1.013×105Pa下测得的几种物质的沸点:
从表中数据分析,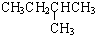 在1.013×105Pa、25℃时的状态是气态(填气态、液态或固态).
在1.013×105Pa、25℃时的状态是气态(填气态、液态或固态).
(2)石油裂解是一个复杂的过程,其产物为混合物.例如:
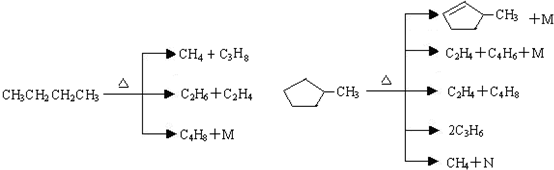
①上述烷烃和环烷烃裂解反应中,产物M的化学式为H2,N的化学式为C5H8.
②下列关于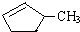 的说法正确的是A.
的说法正确的是A.
A.可用溴水区别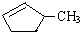 和
和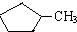
B.等质量的 和
和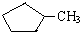 完全燃烧时的耗氧量相同
完全燃烧时的耗氧量相同
C.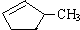 可与水以任意比互溶
可与水以任意比互溶
(3)工业上裂解反应的产物都是气态小分子烷烃和烯烃的混合物,将它们逐一分离的方法是降低温度.
| 结构简式 | 沸点/℃ | 结构简式 | 沸点/℃ |
| CH3CH3 | -88.6 | CH2=CH2 | -103.7 |
| CH3CH2CH3 | -42.2 | CH2=CHCH3 | -47.4 |
| CH3CH2CH2CH3 | -0.5 | CH3CH2CH=CH2 | -6.3 |
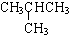 | -11.7 | 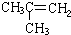 | -6.9 |
| CH3CH2CH2CH2CH3 | 36.1 | CH3CH2CH2CH=CH2 | 30 |
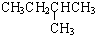 | 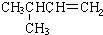 | 20.1 |
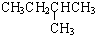 在1.013×105Pa、25℃时的状态是气态(填气态、液态或固态).
在1.013×105Pa、25℃时的状态是气态(填气态、液态或固态).(2)石油裂解是一个复杂的过程,其产物为混合物.例如:

①上述烷烃和环烷烃裂解反应中,产物M的化学式为H2,N的化学式为C5H8.
②下列关于
 的说法正确的是A.
的说法正确的是A.A.可用溴水区别
 和
和
B.等质量的
 和
和 完全燃烧时的耗氧量相同
完全燃烧时的耗氧量相同C.
 可与水以任意比互溶
可与水以任意比互溶(3)工业上裂解反应的产物都是气态小分子烷烃和烯烃的混合物,将它们逐一分离的方法是降低温度.