题目内容
20.请回答下列问题:Ⅰ.如图所示原电池
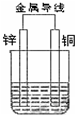
(1)当电解质溶液为H2SO4溶液时,Cu片的电极反应式为2H++2e-=H2↑.
(2)当电解质溶液为CuSO4溶液时,Cu片的电极反应式为Cu2++2e-=Cu.
(3)当电解质溶液为稀食盐水时,Cu片的电极反应式为O2+2H2O+4e-=4OH-.
Ⅱ.由反应2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O,设计出以稀硫酸为电解质溶液的燃料电
池,其电极反应式为:负极2H2-4e-=4H+,正极O2+4H++4e-=2H2O.
分析 Ⅰ.(1)当电解质溶液为H2SO4溶液时,锌是负极,铜极上是氢离子得到电子;
(2)当电解质溶液为CuSO4溶液时,锌是负极,铜极上是铜离子得到电子生成单质铜;
(3)当电解质溶液为稀食盐水时,发生吸氧腐蚀,铜是正极发生还原反应;
Ⅱ.正极是氧气发生还原反应,而电解溶液是酸与氢离子结合成水,负极是氢气发生氧化反应.
解答 解:Ⅰ(1)当电解质溶液为H2SO4溶液时,锌是负极,铜极上是氢离子得到电子,所以Cu片的电极反应式为2H++2e-=H2↑,故答案为:2H++2e-=H2↑;
(2)当电解质溶液为CuSO4溶液时,锌是负极,铜极上是铜离子得到电子生成单质铜,电极反应式为:Cu2++2e-=Cu,故答案为:Cu2++2e-=Cu;
(3)当电解质溶液为稀食盐水时,发生吸氧腐蚀,铜是正极发生还原反应,氧气得电子,生成氢氧根离子,电极反应式为:O2+2H2O+4e-=4OH-,故答案为:O2+2H2O+4e-=4OH-;
Ⅱ.负极是氢气发生氧化反应,电极反应式为:2H2-4e-=4H+;正极是氧气发生还原反应,而电解溶液是酸与氢离子结合成水,电极反应式为O2+4H++4e-=2H2O,
故答案为:2H2-4e-=4H+;O2+4H++4e-=2H2O.
点评 本题考查了原电池原理,明确各个电极上得失电子及发生的反应即可解答,难点是电极反应式的书写,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.(1)A和B单质燃烧时均放出大量热,可用作燃料.已知A和B为短周期元素,其原子的第一至第四电离能如表所示:
根据上述信息,写出B的基态原子核外电子排布式1s22s22p63s2,预测A和氯元素形成的简单分子空间构型为直线型.
(2)钴(Co)可形成分子式均为Co(NH3)5BrSO4的两种配合物,往其中一种配合物的溶液中加入AgNO3溶液时,无明显现象,往其溶液中加BaCl2溶液时若,产生白色沉淀,则该配合物的化学式为[Co(Br)(NH3)5]SO4,中心离子的配位数为6.
(3)参考下表中的物质熔点回答下列问题
根据上表数据解释钠的卤化物及碱金属的氯化物的熔点变化规律随阴阳离子的半径增大,熔降低点.
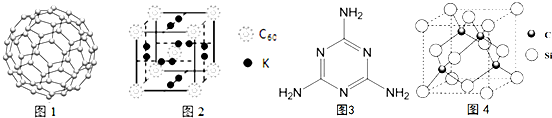
(4)C60可用作储氢材料.C60的结构如图1.已知金刚石中的C-C的键长为154.45pm,C60中C-C键长为145~140pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确不正确,并阐述理由C60是分子晶体,熔化时不需破坏化学键.科学家把C60和钾掺杂在一起制造了一种富勒烯化合物,其晶胞如图2所示,该物质在低温时是一种超导体,该物质的K原子和C60分子的个数比为3:1.
 σ
σ
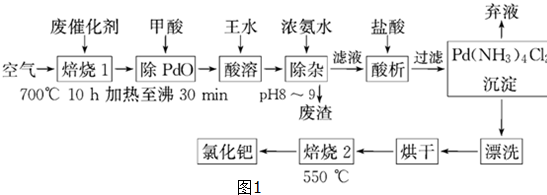
(5)三聚氰胺分子的结构简式如图3,则其中氮原子轨道杂化类型是sp2、sp3,l mol三聚氰胺分子中含15molσ键.
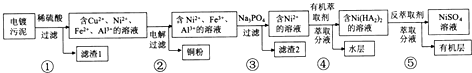
(6)碳化硅的晶胞与金刚石的晶胞相似如图4,设晶胞边长为a cm,碳原子直径为b cm,硅原子直径为c cm,则该晶胞的空间利用率为$\frac{2π({b}^{3}+{c}^{3})}{3{a}^{3}}$×100%.(用含a、b、c的式子表示).
| 电离能(KJ/mol) | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |
(2)钴(Co)可形成分子式均为Co(NH3)5BrSO4的两种配合物,往其中一种配合物的溶液中加入AgNO3溶液时,无明显现象,往其溶液中加BaCl2溶液时若,产生白色沉淀,则该配合物的化学式为[Co(Br)(NH3)5]SO4,中心离子的配位数为6.
(3)参考下表中的物质熔点回答下列问题
| 物质 | NaF | NaCl | NaBr | NaI | NaCl | KCl | RbCl | CsCl |
| 熔点(℃) | 995 | 801 | 755 | 651 | 801 | 776 | 715 | 646 |
(4)C60可用作储氢材料.C60的结构如图1.已知金刚石中的C-C的键长为154.45pm,C60中C-C键长为145~140pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确不正确,并阐述理由C60是分子晶体,熔化时不需破坏化学键.科学家把C60和钾掺杂在一起制造了一种富勒烯化合物,其晶胞如图2所示,该物质在低温时是一种超导体,该物质的K原子和C60分子的个数比为3:1.
 σ
σ(5)三聚氰胺分子的结构简式如图3,则其中氮原子轨道杂化类型是sp2、sp3,l mol三聚氰胺分子中含15molσ键.
(6)碳化硅的晶胞与金刚石的晶胞相似如图4,设晶胞边长为a cm,碳原子直径为b cm,硅原子直径为c cm,则该晶胞的空间利用率为$\frac{2π({b}^{3}+{c}^{3})}{3{a}^{3}}$×100%.(用含a、b、c的式子表示).
11.下列各组物质中,都是共价化合物的是( )
| A. | H2O2和CaF2 | B. | H2S和Na2O2 | C. | HNO3和HClO4 | D. | NH3和N2 |
5.下列关于反应:XeF4+2CH3-CH=CH2?→2CH3CH2-CHF2+Xe的说法正确的是( )
| A. | XeF4被氧化 | B. | 该反应是非氧化还原反应 | ||
| C. | XeF4既是氧化剂又是还原剂 | D. | CH3-CH=CH2是还原剂 |
2.下列说法正确的是( )
| A. | 2NO(g)+2CO(g)═N2(g)+2CO2(g)该反应是熵减的反应 | |
| B. | 纯锌与稀硫酸反应时,加入少量CuSO4溶液,可使反应速率减慢 | |
| C. | 增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成H2的速率 | |
| D. | 由H2(g)+1/2O2(g)═H2O(g)△H=-241.8 kJ•mol-1,得出H2的燃烧热是241.8 kJ•mol-1 |
3.医学研究证明,用放射性${\;}_{53}^{136}$I治疗肿瘤可收到一定疗效,下列有关${\;}_{53}^{136}$I叙述正确的是( )
| A. | ${\;}_{53}^{136}$I是碘的一种同素异形体 | |
| B. | ${\;}_{53}^{136}$I位于元素周期表中第四周期ⅦA族 | |
| C. | ${\;}_{53}^{136}$I是一种新发现的元素 | |
| D. | ${\;}_{53}^{136}$I核内的中子数与核外电子数之差为29 |

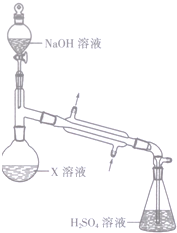 某浅绿色晶体X[x(NH4)2SO4•yFeSO4•zH2O]在分析化学上常用作还原剂.为确定其组成,某小组同学进行如下实验.
某浅绿色晶体X[x(NH4)2SO4•yFeSO4•zH2O]在分析化学上常用作还原剂.为确定其组成,某小组同学进行如下实验.