题目内容
【题目】镓是制作高性能半导体的重要原料。工业上常从锌矿冶炼的废渣中回收镓。已知某锌矿渣主要含Zn、Si、Pb、Fe、Ga的氧化物,利用该矿渣制镓的工艺流程如下: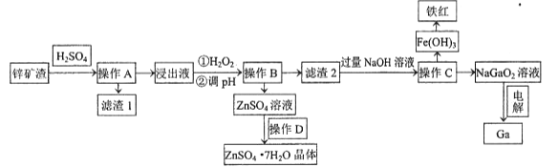
已知:①镓在元素周期表中位于第四周期第ⅢA族,化学性质与铝相似。
②lg2=0.3 lg3=0.48。
③部分物质的Ksp如下表所示。
物质 | Zn(OH)2 | Ga(OH)3 | Fe(OH)2 | Fe(OH)3 |
Ksp | 1.6×10-17 | 2.7×10-31 | 8×10-16 | 2.8×10-39 |
(1)为了提高酸浸速率,除适当增加硫酸浓度外,应采取的措施有__________________(写出两条)。滤渣1的主要成分是硫酸铅及_________________(写化学式)。
(2)加入H2O2的目的是(用离子方程式表示)______________________ 。
(3)室温条件下,若浸出液中各阳离子的浓度均为0.01mo/L,当溶液中某种离子浓度小于1×10-5mol/L时即认为该离子已完全除去,则pH应调节的范围为___________________。
(4)操作D包括:_______________过滤、洗涤、干燥。
(5)电解法制备金属镓。用惰性电极电解NaGaO2溶液即可制得金属镓,写出阴极电极反应式________________________。
【答案】升高温度、粉碎、搅拌等 SiO2 2Fe2++H2O2+2H+=2Fe3++2H2O 5.48<pH<6.6 蒸发浓缩、冷却结晶 GaO2-+2H2O+3e-=Ga+4OH-
【解析】
某锌矿渣主要含Zn、Si、Pb、Fe、Ga的氧化物,加入硫酸,经过滤,得到滤渣Ⅰ为SiO2、PbSO4,浸出液含有Zn、Fe、Ga的离子,加入过氧化氢,可氧化亚铁离子生成铁离子,调节溶液pH生成Fe(OH)3、Ga(OH)3沉淀,滤液含有硫酸锌,经蒸发浓缩、冷却结晶可得到硫酸锌晶体,滤渣2含有Fe(OH)3、Ga(OH)3,加入过量的氢氧化钠,可生成NaGaO2溶液,过滤得到有Fe(OH)3,分解可生成氧化铁,电解NaGaO2溶液,可制备Ga,以此解答该题。
(1)为了提高酸浸速率,除适当增加硫酸浓度外,应采取的措施有将矿物质粉碎、升高温度、搅拌等;由以上分析可知滤渣1为SiO2、PbSO4;
(2)在滤液中加入H2O2的目的是氧化Fe2+,调节溶液pH沉淀Fe3+,反应的离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O;
(3)调pH的目的是使Fe3+、Ga3+沉淀完全而Zn2+不沉淀,Ga(OH)3完全沉淀时,c(OH-)=![]() mol/L=3×10-9mol/L,则此时溶液的pH=5.48;如生成Zn(OH)2,则c(OH-)=
mol/L=3×10-9mol/L,则此时溶液的pH=5.48;如生成Zn(OH)2,则c(OH-)=![]() mol/L=4×10-8mol/L,则此时溶液的pH=6.6,故应调节pH范围为5.48<pH<6.6;
mol/L=4×10-8mol/L,则此时溶液的pH=6.6,故应调节pH范围为5.48<pH<6.6;
(4)操作D得到晶体,涉及操作为:蒸发浓缩,冷却结晶过滤、洗涤、干燥;
(5)①阴极上GaO2-发生还原反应生成Ga,电极方程式为GaO2-+2H2O+3e-=Ga+4OH-。

 阅读快车系列答案
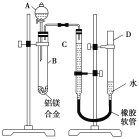
阅读快车系列答案【题目】某同学利用下图进行喷泉实验,已知圆底烧瓶内充满X气体,胶头滴管内装有少量Y液体,烧杯内装有足量Z液体,下列组合能进行喷泉实验且最终液体一定能充满整个烧瓶的是( )
X气体 | Y试剂 | Z试剂 | |
A. | NO2 | H2O | H2O |
B. | CO2 | H2O | H2O |
C. | HCl | 饱和食盐水 | 水 |
D. | NO2 和O2 | H2O | H2O |
A.AB.BC.CD.D