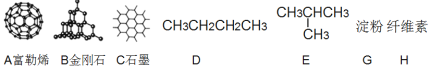题目内容
【题目】下面对SO2和CO2的描述正确的是
A. SO2为原子晶体,CO2为分子晶体
B. 中心原子采取的杂化方式:SO2为sp2杂化,CO2为sp杂化
C. 都是直线形结构
D. S原子和C原子上都没有孤电子对
【答案】B
【解析】
A.SO2、CO2都是分子晶体,故A错误;
B.SO2中S原子形成2个σ键,孤电子对个数=![]() ×(6-2×2)=1,价层电子对数为3,为sp2杂化;而二氧化碳分子中价层电子对个数=σ键个数+孤电子对个数=2+
×(6-2×2)=1,价层电子对数为3,为sp2杂化;而二氧化碳分子中价层电子对个数=σ键个数+孤电子对个数=2+![]() (4-2×2)=2,采取sp杂化方式,故B正确;
(4-2×2)=2,采取sp杂化方式,故B正确;
C.SO2中S原子为sp2杂化,SO2为折线型,而二氧化碳分子中碳原子采取sp杂化方式,二氧化碳为直线型,故C错误;
D.SO2中S原子上有孤电子对,二氧化碳无孤电子对,故D错误;
答案选B。

【题目】镓是制作高性能半导体的重要原料。工业上常从锌矿冶炼的废渣中回收镓。已知某锌矿渣主要含Zn、Si、Pb、Fe、Ga的氧化物,利用该矿渣制镓的工艺流程如下: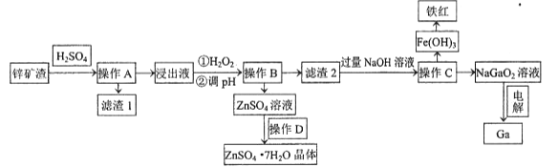
已知:①镓在元素周期表中位于第四周期第ⅢA族,化学性质与铝相似。
②lg2=0.3 lg3=0.48。
③部分物质的Ksp如下表所示。
物质 | Zn(OH)2 | Ga(OH)3 | Fe(OH)2 | Fe(OH)3 |
Ksp | 1.6×10-17 | 2.7×10-31 | 8×10-16 | 2.8×10-39 |
(1)为了提高酸浸速率,除适当增加硫酸浓度外,应采取的措施有__________________(写出两条)。滤渣1的主要成分是硫酸铅及_________________(写化学式)。
(2)加入H2O2的目的是(用离子方程式表示)______________________ 。
(3)室温条件下,若浸出液中各阳离子的浓度均为0.01mo/L,当溶液中某种离子浓度小于1×10-5mol/L时即认为该离子已完全除去,则pH应调节的范围为___________________。
(4)操作D包括:_______________过滤、洗涤、干燥。
(5)电解法制备金属镓。用惰性电极电解NaGaO2溶液即可制得金属镓,写出阴极电极反应式________________________。