题目内容
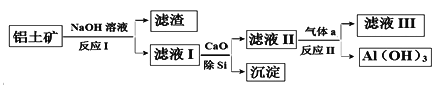
【题目】铬元素及其化合物在生产、生活中具有广泛的用途。以某铬矿石(主要成分是Cr2O3,含Fe2O3、SiO2等杂质)为原料生产Cr2O3的流程如下:
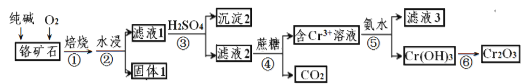
(1)Cr2O3在焙烧时生成Na2CrO4,写出第①步发生的所有方程式_________。
(2)沉淀2的化学式为_______。
(3)步骤③中CrO42-转化成Cr2O72- ,写出其离子方程式_______,硫酸能否换成盐酸并说明其理由______。
(4)滤液3中主要溶质的化学式为____________。
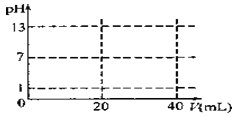
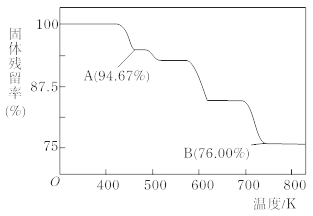
(5)CrO3的热稳定性较差,加热时逐步分解,其固体残留率随温度的变化如下图所示,则B点时铬的氧化物化学式为_______。
【答案】2Cr2O3+4Na2CO3+3O2![]() 4Na2CrO4+4CO2,Na2CO3+SiO2
4Na2CrO4+4CO2,Na2CO3+SiO2![]() Na2SiO3+CO2↑ H2SiO3 Cr2O72-+H2O
Na2SiO3+CO2↑ H2SiO3 Cr2O72-+H2O![]() 2CrO42-+2H+ 不能,HCl能被Cr2O72-氧化成氯气 Na2SO4、(NH4)2SO4 Cr2O3
2CrO42-+2H+ 不能,HCl能被Cr2O72-氧化成氯气 Na2SO4、(NH4)2SO4 Cr2O3
【解析】
铬铁矿(主要成分是Cr2O3,含Fe2O3、SiO2等杂质)加入碳酸钠煅烧,可生成Na2CrO4、Na2SiO3等,加入水浸取,过滤得到滤渣为Fe2O3,滤液1为Na2CrO4、Na2SiO3等,向滤液1中加入稀硫酸调节pH得到沉淀为H2SiO3,过滤后向滤液中加入蔗糖,用蔗糖还原,得到二氧化碳和含有Na+、Cr3+的溶液,再与氨水反应,滤液3的主要溶质是两种盐为(NH4)2SO4、Na2SO4,得到Cr(OH)3沉淀,灼烧Cr(OH)3沉淀得到Cr2O3,以此解答该题。
(1)加入碳酸钠焙烧,可生成Na2CrO4、Na2SiO3等,涉及的方程式为2Cr2O3+4Na2CO3+3O2![]() 4Na2CrO4+4CO2,SiO2+Na2CO3
4Na2CrO4+4CO2,SiO2+Na2CO3![]() Na2SiO3+CO2↑;
Na2SiO3+CO2↑;
(2)由以上分析可知过滤得滤液1为Na2CrO4、Na2SiO3等,向滤液1中加入稀硫酸调节pH得到沉淀2为H2SiO3;
(3)步骤③中CrO42-转化成Cr2O72- ,反应的离子方程式为:Cr2O72-+H2O![]() 2CrO42-+2H+;盐酸具有还原性,如果用盐酸,则HCl会被CrO42-氧化产生氯气污染环境,所以硫酸不能换成盐酸;
2CrO42-+2H+;盐酸具有还原性,如果用盐酸,则HCl会被CrO42-氧化产生氯气污染环境,所以硫酸不能换成盐酸;
(4)滤液3溶液中存在Na+、NH4+、SO42+等离子,主要溶质是两种盐为Na2SO4、(NH4)2SO4;
(5)设CrO3的质量为100g,则CrO3中铬元素的质量为:100g×![]() =52g,B点时固体的质量为:100g×76%=76g,Cr的质量没有变,所以生成物中Cr的质量为52g,氧元素的质量为:76g-52g=24g,两者的个数比为
=52g,B点时固体的质量为:100g×76%=76g,Cr的质量没有变,所以生成物中Cr的质量为52g,氧元素的质量为:76g-52g=24g,两者的个数比为![]() :
:![]() =2:3,所以B点时剩余固体的成分是Cr2O3。
=2:3,所以B点时剩余固体的成分是Cr2O3。

【题目】镓是制作高性能半导体的重要原料。工业上常从锌矿冶炼的废渣中回收镓。已知某锌矿渣主要含Zn、Si、Pb、Fe、Ga的氧化物,利用该矿渣制镓的工艺流程如下: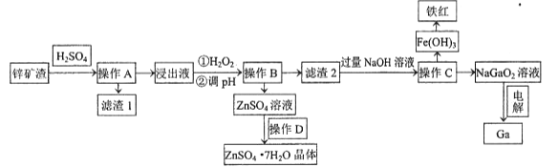
已知:①镓在元素周期表中位于第四周期第ⅢA族,化学性质与铝相似。
②lg2=0.3 lg3=0.48。
③部分物质的Ksp如下表所示。
物质 | Zn(OH)2 | Ga(OH)3 | Fe(OH)2 | Fe(OH)3 |
Ksp | 1.6×10-17 | 2.7×10-31 | 8×10-16 | 2.8×10-39 |
(1)为了提高酸浸速率,除适当增加硫酸浓度外,应采取的措施有__________________(写出两条)。滤渣1的主要成分是硫酸铅及_________________(写化学式)。
(2)加入H2O2的目的是(用离子方程式表示)______________________ 。
(3)室温条件下,若浸出液中各阳离子的浓度均为0.01mo/L,当溶液中某种离子浓度小于1×10-5mol/L时即认为该离子已完全除去,则pH应调节的范围为___________________。
(4)操作D包括:_______________过滤、洗涤、干燥。
(5)电解法制备金属镓。用惰性电极电解NaGaO2溶液即可制得金属镓,写出阴极电极反应式________________________。