题目内容
11.关于如图所示实验的说法不正确的是( )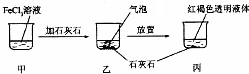
| A. | 反应过程中产生的气体是CO2 | |
| B. | 丙中液体可产生“丁达尔效应” | |
| C. | 若忽略溶液体积的变化,烧杯中c(Cl- )不发生变化 | |
| D. | 若在丙中加入过量盐酸,充分反应后所得溶液组成与甲相同 |
分析 A.氯化铁溶液中铁离子水解显酸性,和碳酸钙反应生成二氧化碳;
B.氯化铁水解形成氢氧化铁胶体,胶体具有“丁达尔效应”;
C.Fe3++3H2O?Fe(OH)3(胶体)+3H+,碳酸钙和酸反应促进水解形成氢氧化铁胶体,烧杯中c(Cl- )不发生变化;
D.若在丙中加入过量盐酸,丙中既有盐酸又有氯化铁,而甲中只有氯化铁.
解答 解:A.氯化铁溶液中铁离子水解显酸性,和碳酸钙反应生成二氧化碳,反应过程中产生的气泡是CO2 气体,故A正确;
B.丙中最终所得红褐色液体为氢氧化铁胶体,胶体具有“丁达尔效应”,故B正确;
C.铁离子水解显酸性,碳酸钙和酸反应促进水解形成氢氧化铁胶体,最终所得红褐色液体为氢氧化铁胶体,烧杯中c(Cl- )不发生变化,故C正确;
D.丙中液体组成为氢氧化铁胶体,加入过量盐酸,平衡水解平衡破坏,丙中既有盐酸又有氯化铁,而甲中只有氯化铁,故D错误;
故选D.
点评 本题考查了盐类水解原理、影响水解平衡的分析应用,掌握基础是关键,题目难度中等.

练习册系列答案
相关题目
2.下列图示与对应的叙述相符的( )
| A. | 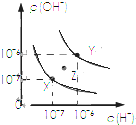 表示不同条件下水的电离平衡曲线,图中各点温度:X>Z>Y | |
| B. | 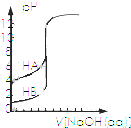 表示浓度相同的两种一元酸分别用0.1 mol/L NaOH溶液滴定曲线,酸性:HA>HB | |
| C. | 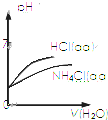 表示pH相同的NH4Cl溶液和HCl溶液分别加同体积水稀释二者pH的变化曲线 | |
| D. | 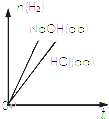 表示向等体积、等物质的量浓度的盐酸和NaOH溶液中分别加入足量铝粉,产生H2的物质的量随时间的变化曲线 |
19.下列物质属于合成高分子化合物的是( )
| A. | 淀粉 | B. | 蚕丝 | C. | 聚氯乙烯 | D. | 纤维素 |
6.化学在生产和生活中有着重要的作用,下列有关说法不正确的是( )
| A. | 铝需经过特别处理能具有抗腐蚀能力 | |
| B. | “地沟油”经过加工处理可用来制肥皂 | |
| C. | 嫦娥系列卫星中使用的碳纤维,是一种新型无机非金属材料 | |
| D. | 只要符合限量,“食用色素”、“亚硝酸盐”可以作为某些食品的添加剂 |
16.下列溶液中,有关物质的量浓度关系正确的是( )
| A. | 向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液:c(Na+ )=c(NO3 - ) | |
| B. | 1.0 mol•L-1Na2CO3 溶液:c(OH-)=c(HCO3-)+c(H+) | |
| C. | pH=8.0的KHS溶液中,c(K+)>c(HS-)>c(OH-)>c(S2-)>c(H+) | |
| D. | 将0.2 mol•L-1的某一元酸HA溶液和0.1 mol•L-1NaOH溶液等体积混合后,溶液pH大于7,则反应后的混合液中:2c(OH-)+c (A-)=2c(H+)+c(HA) |
3. 在密闭容器中,1molH2与1molCO发生反应:CO(g)+2H2(g)?CH3OH(g),△H<0,反应达到平衡时,改变温度(T)和压强(P),反应混合物中甲醇的物质的量分数变化情况如图所示,下列说法正确的是( )
在密闭容器中,1molH2与1molCO发生反应:CO(g)+2H2(g)?CH3OH(g),△H<0,反应达到平衡时,改变温度(T)和压强(P),反应混合物中甲醇的物质的量分数变化情况如图所示,下列说法正确的是( )
 在密闭容器中,1molH2与1molCO发生反应:CO(g)+2H2(g)?CH3OH(g),△H<0,反应达到平衡时,改变温度(T)和压强(P),反应混合物中甲醇的物质的量分数变化情况如图所示,下列说法正确的是( )
在密闭容器中,1molH2与1molCO发生反应:CO(g)+2H2(g)?CH3OH(g),△H<0,反应达到平衡时,改变温度(T)和压强(P),反应混合物中甲醇的物质的量分数变化情况如图所示,下列说法正确的是( )| A. | P1<P2<P3<P4 | |
| B. | T1<T2<T3<T4 | |
| C. | T4和P1状态下,H2的平衡转化率为8/9 | |
| D. | 甲醇的物质的量分数越小,反应的平衡常数越小 |
20.近年来,乳酸成为研究热点之一,以乳酸为原料制成的高分子材料具有生物兼容性.已知乳酸的结构简式为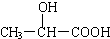 ,下列物质中能与乳酸反应的是( )
,下列物质中能与乳酸反应的是( )
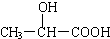 ,下列物质中能与乳酸反应的是( )
,下列物质中能与乳酸反应的是( )| A. | 金属铁 | B. | NH4Cl溶液 | C. | 乙烷 | D. | 苯 |

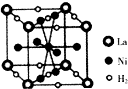 镍及其化合物在合金材料以及催化剂等方面应用广泛.
镍及其化合物在合金材料以及催化剂等方面应用广泛. 、④HCHO,其中碳原子采取sp2杂化的分子有①③④(填序号),HCHO分子的立体结构为平面三角形;HC≡CH分子内σ键与π键个数之比为3:2.
、④HCHO,其中碳原子采取sp2杂化的分子有①③④(填序号),HCHO分子的立体结构为平面三角形;HC≡CH分子内σ键与π键个数之比为3:2.