题目内容
2.下列图示与对应的叙述相符的( )| A. | 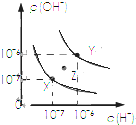 表示不同条件下水的电离平衡曲线,图中各点温度:X>Z>Y | |
| B. | 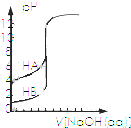 表示浓度相同的两种一元酸分别用0.1 mol/L NaOH溶液滴定曲线,酸性:HA>HB | |
| C. | 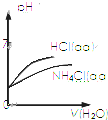 表示pH相同的NH4Cl溶液和HCl溶液分别加同体积水稀释二者pH的变化曲线 | |
| D. | 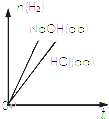 表示向等体积、等物质的量浓度的盐酸和NaOH溶液中分别加入足量铝粉,产生H2的物质的量随时间的变化曲线 |
分析 A、水的电离吸热,温度越高水的离子积越大;
B、相同浓度的不同酸,酸性越强其pH越小;
C、氯化铵加水稀释时,促进水解,氢离子物质的量增大,盐酸加水稀释,氢离子物质的量不变;
D、2molAl与6molHCl反应生成3mol氢气,2molAl与2molNaOH反应生成3mol氢气.
解答 解:A、表示不同条件下水的电离平衡曲线,图中各点温度:Y>Z>X,故A错误;
B、HA与HB浓度相同,pH小的是HB,所以酸性HB>HA,故B错误;
C、氯化铵加水稀释时,促进水解,氢离子物质的量增大,盐酸加水稀释,氢离子物质的量不变,所以盐酸加水稀释pH变化大,故C正确;
D、产生相同量的氢气,小于盐酸的物质的量大于氢氧化钠,故D错误;
故选C.
点评 本题考查较为综合,涉及水的离子积常数、酸性强弱与pH的关系、盐类水解、据化学方程式计算,侧重于学生的分析能力的考查,为高频考点,注意相关基础知识的积累,难度不大.

练习册系列答案
相关题目
12.短周期元素A、B、C、D的原子序数逐渐增大,A、B的最高正价与最低负价之和都为0,D与A同主族,C的一种单质具有杀菌的作用,少量能使人精神振奋,E的合金是目前使用比较广泛的合金,下列说法正确的是( )
| A. | 简单离子的半径:r(A)<r(C)<r(D)<r(E) | |
| B. | 元素B的最简单气态氧化物的稳定性比C的强 | |
| C. | D2C2与A2C2的漂白原理相同 | |
| D. | 元素E的氧化物能溶于B或D的最高价氧化物对应的水化物中 |
13.X、Y、Z、W、R是周期表前20号元素,它们的原子序数依次增大,X与R,Y与W分别同主族,Z原子最外电子数是W原子最外层电子数的一半,X与Y可形成X2Y和X2Y2两种液态化合物.下列说法不正确的是( )
| A. | 25℃时0.1mol/LX2W溶液的pH>1-lg2 | |
| B. | 溶液中水的电离程度:RYX>R2W | |
| C. | 热稳定性:X2Y>X2W | |
| D. | 由X、Y、Z、W、R五种元素组成的一种化合物可作净水剂 |
17.测得苯、乙炔、乙二醇、乙酸乙酯的混合物中含碳量为66.0%,则该混合物中含氧量为( )
| A. | 30.8% | B. | 28.6% | C. | 25.3% | D. | 22.7% |
7.用下列装置完成相关实验,不合理的是( )
| A. | 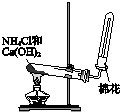 用a制备并收集氨气 | B. | 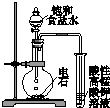 用b制备并检验乙炔 | ||
| C. | 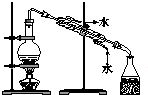 用c蒸馏海水得到淡水 | D. | 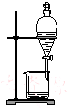 用d分离Na2CO3溶液与CH3COOC2H5 |
14.下列溶液中的Cl-浓度与100mL 1mol•L-1 MgCl2溶液中的Cl-浓度相等的是( )
| A. | 150mL 2mol•L-1 KCl溶液 | B. | 75mL 0.5mol•L-1CaCl2溶液 | ||
| C. | 150mL 1mol•L-1 NaCl溶液 | D. | 75mL 1mol•L-1AlCl3溶液 |
11.关于如图所示实验的说法不正确的是( )
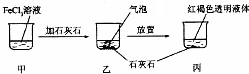

| A. | 反应过程中产生的气体是CO2 | |
| B. | 丙中液体可产生“丁达尔效应” | |
| C. | 若忽略溶液体积的变化,烧杯中c(Cl- )不发生变化 | |
| D. | 若在丙中加入过量盐酸,充分反应后所得溶液组成与甲相同 |
6.下列萃取与分液结合进行的操作(用CCl4作萃取剂,从碘水中萃取碘)中错误的是( )
| A. | 饱和碘水和CCl4加入分液漏斗中后,塞上上口部的塞子,用一手压住分液漏斗上口部,一手握住活塞部分,把分液漏斗倒转过来振荡 | |
| B. | 静置,待分液漏斗中液体分层后,先使分液漏斗内外空气相通(准备放出液体) | |
| C. | 打开分液漏斗的活塞,使全部下层液体沿承接液体的烧杯内壁慢慢流出 | |
| D. | 最后继续打开活塞,另用容器承接并保存上层液体 |
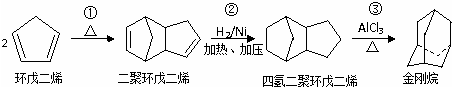
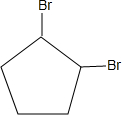 +2NaOH$→_{△}^{乙醇}$
+2NaOH$→_{△}^{乙醇}$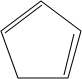 +2NaBr+2H2O;
+2NaBr+2H2O;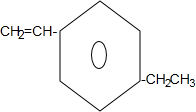 .
.