题目内容
1.工业合成氨技术是对人类的巨大贡献之一.下面是合成氨的简要流程示意图:
(1)设备 I的名称是合成塔,沿X路线循环的物质是A(填字母).
A.N2和H2 B.催化剂 C.NH3D.N2、H2和NH3
(2)合成氨中H2可以由焦炭和水蒸汽反应获得.请写出该反应的化学方程式:C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2 .
(3)原料气中往往含有H2S、CO、CO2等杂质,必须除去这些杂质的目的是防止催化剂中毒,常用K2CO3溶液除去CO2,其反应的离子方程式为CO32-+CO2+H2O=2HCO3-.
(4)近年有人将电磁场直接加在氮气和氢气反应的容器内,在较低的温度和压强条件下合成氨,获得了较高的产率.电磁场对合成氨反应本质的影响是在电磁场的作用下,氮氮三键更容易断裂,减少了合成氨反应所需的能量,该方法的优点是降低能耗,使反应更容易进行.
(4)合成氨工业往往含有大量含氨废水,为了防止对环境造成污染,可以利用电解法将NH3•H2O转化为对环境无污染的加以处理.电解时以石墨做电极,以硝酸作为电解质,则理论上处理1mol NH3•H2O,电路中转移电子3mol,阳极的电极反应式为2NH3-6e-=N2+6H+.
分析 (1)根据流程可知,设备Ⅰ为合成塔,设备Ⅱ为氨分离器,设备Ⅱ中含有未反应的氮气和氢气,需要循环利用;
(2)碳在高温下与水反应生成一氧化碳和氢气,据此写出反应的化学方程式;
(3)H2S、CO、CO2等杂质容易造成催化剂中毒,降低催化效果,需要将原料气中的杂质除去;碳酸钾与二氧化碳反应生成碳酸氢钾,据此写出反应的离子方程式;
(4)根据能量守恒定律及合成氨的反应特点进行分析;
(5)生成的无污染的物质为氮气,根据电解原理写出阳极电极反应式,然后计算出转移的电子的物质的量.
解答 解:(1)根据合成流程可知,设备Ⅰ为合成塔,设备Ⅱ为氨分离器,合成氨的反应为可逆反应,则设备Ⅱ中含有未反应的N2和H2,需要转入合成塔中循环利用,所以A正确,
故答案为:合成塔;A;
(2)合成氨中H2可以由焦炭和水蒸汽反应获得,反应的化学方程式为:C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2 ,
故答案为:C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2 ;
(3)原料气中的H2S、CO、CO2等杂质容易造成催化剂中毒,降低催化效果,所以必须将原料气中往往含有的H2S、CO、CO2等杂质除去,防止催化剂中毒;碳酸钾溶液与二氧化碳反应生成碳酸氢钾,反应的离子方程式为:CO32-+CO2+H2O=2HCO3-,
故答案为:防止催化剂中毒;CO32-+CO2+H2O=2HCO3-;
(4)在较低的温度和压强条件下合成氨,获得了较高的产率,而一般合成氨需要较高温度和压强,所以通过能量守恒可知,电磁场可以断裂化学键,降低能耗,
故答案为:在电磁场的作用下,氮氮三键更容易断裂,减少了合成氨反应所需的能量;降低能耗,使反应更容易进行(其他合理答案也可);
(5)利用电解法将NH3•H2O转化为对环境无污染的物质为氮气,阳极失去电子发生氧化反应,电极反应式为:2NH3-6e-=N2+6H+,则1molNH3•H2O完全反应转移了3mol电子,
故答案为:3; 2NH3-6e-=N2+6H+.
点评 本题以工业合成氨流程为载体,对化工生产的相关知识进行考查,题目难度中等,试题重点考查了学生对合成氨的设备及流程的掌握情况,同时也考察了学生分析评价的能力,注意掌握合成氨的反应原理.

 教学练新同步练习系列答案
教学练新同步练习系列答案| A. | 简单离子的半径:r(A)<r(C)<r(D)<r(E) | |
| B. | 元素B的最简单气态氧化物的稳定性比C的强 | |
| C. | D2C2与A2C2的漂白原理相同 | |
| D. | 元素E的氧化物能溶于B或D的最高价氧化物对应的水化物中 |
| A. | CO2、CH3COOH均为共价化合物 | |
| B. | 每生成1molCH3COOH,要消耗22.4LCO2 | |
| C. | CO2、CH3COOH分子中均含σ键和π键 | |
| D. | CH4$→_{-H_{2}}^{催化剂}$CHX属于氧化反应 |
| A. | 6种 | B. | 8种 | C. | 10种 | D. | 12种 |
| A. | 25℃时0.1mol/LX2W溶液的pH>1-lg2 | |
| B. | 溶液中水的电离程度:RYX>R2W | |
| C. | 热稳定性:X2Y>X2W | |
| D. | 由X、Y、Z、W、R五种元素组成的一种化合物可作净水剂 |
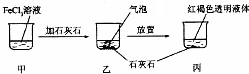
| A. | 反应过程中产生的气体是CO2 | |
| B. | 丙中液体可产生“丁达尔效应” | |
| C. | 若忽略溶液体积的变化,烧杯中c(Cl- )不发生变化 | |
| D. | 若在丙中加入过量盐酸,充分反应后所得溶液组成与甲相同 |
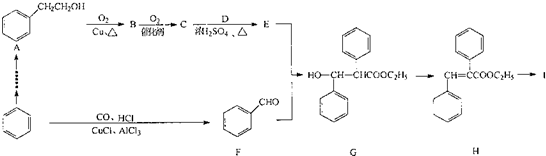
 .
. +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2 +2H2O:E+F--G的反应类型为加成反应.
+2H2O:E+F--G的反应类型为加成反应. +NaOH$\stackrel{△}{→}$C2H5OH+
+NaOH$\stackrel{△}{→}$C2H5OH+ .
.
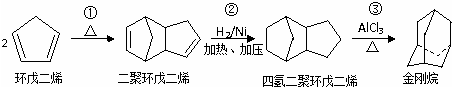
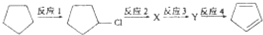
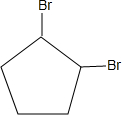 +2NaOH$→_{△}^{乙醇}$
+2NaOH$→_{△}^{乙醇}$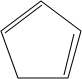 +2NaBr+2H2O;
+2NaBr+2H2O;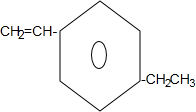 .
.