题目内容
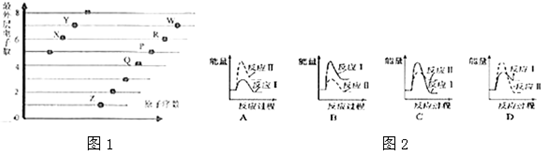
3. 在密闭容器中,1molH2与1molCO发生反应:CO(g)+2H2(g)?CH3OH(g),△H<0,反应达到平衡时,改变温度(T)和压强(P),反应混合物中甲醇的物质的量分数变化情况如图所示,下列说法正确的是( )
在密闭容器中,1molH2与1molCO发生反应:CO(g)+2H2(g)?CH3OH(g),△H<0,反应达到平衡时,改变温度(T)和压强(P),反应混合物中甲醇的物质的量分数变化情况如图所示,下列说法正确的是( )| A. | P1<P2<P3<P4 | |
| B. | T1<T2<T3<T4 | |
| C. | T4和P1状态下,H2的平衡转化率为8/9 | |
| D. | 甲醇的物质的量分数越小,反应的平衡常数越小 |
分析 A、增大压强,平衡正向移动,结合图象判断甲醇的物质的量分数变化情况判断压强大小;
B、温度升高,平衡向着吸热方向进行,反之向着放热方向进行;
C、根据转化率等于变化量和初始量的比值,列出三段式进行计算即可;
D、△H<0,升高温度,平衡逆向移动.
解答 解:A、增大压强,平衡正向移动,则反应混合物中甲醇(CH3OH)的物质的量分数逐渐增大,即P1>P2>P3>P4,故A错误;
B、CO(g)+2H2(g)?CH3OH(g),△H<0,此反应为放热反应,故升高温度,甲醇的含量减小,故T1>T2>T3>T4,故B错误;
C、T4、P1时,甲醇的物质的量分数是0.4,设消耗氢气的物质的量是2x,
2H2(g)十CO(g)≒CH3OH(g)
初始量:1 1 0
变化量:2x x x
平衡量:1-2x 1-x x
$\frac{x}{1-2x+1-x+x}$=0.4,解得x=$\frac{4}{9}$,所以H2的平衡转化率为$\frac{\frac{4}{9}×2}{1}$×100%=$\frac{8}{9}$,故C正确;
D、平衡常数只受温度的影响,△H<0,升高温度,平衡逆向移动,甲醇的物质的量分数减小,反应的平衡常数减小,但甲醇的物质的量分数的高低和反应的平衡常数之间没有关系,故D错误;
故选C.
点评 本题考查学生化学平衡的影响因素以及化学平衡的计算知识,属于综合知识的考查,难度不大.

练习册系列答案
相关题目
13.X、Y、Z、W、R是周期表前20号元素,它们的原子序数依次增大,X与R,Y与W分别同主族,Z原子最外电子数是W原子最外层电子数的一半,X与Y可形成X2Y和X2Y2两种液态化合物.下列说法不正确的是( )
| A. | 25℃时0.1mol/LX2W溶液的pH>1-lg2 | |
| B. | 溶液中水的电离程度:RYX>R2W | |
| C. | 热稳定性:X2Y>X2W | |
| D. | 由X、Y、Z、W、R五种元素组成的一种化合物可作净水剂 |
14.下列溶液中的Cl-浓度与100mL 1mol•L-1 MgCl2溶液中的Cl-浓度相等的是( )
| A. | 150mL 2mol•L-1 KCl溶液 | B. | 75mL 0.5mol•L-1CaCl2溶液 | ||
| C. | 150mL 1mol•L-1 NaCl溶液 | D. | 75mL 1mol•L-1AlCl3溶液 |
11.关于如图所示实验的说法不正确的是( )
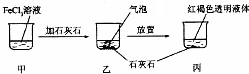

| A. | 反应过程中产生的气体是CO2 | |
| B. | 丙中液体可产生“丁达尔效应” | |
| C. | 若忽略溶液体积的变化,烧杯中c(Cl- )不发生变化 | |
| D. | 若在丙中加入过量盐酸,充分反应后所得溶液组成与甲相同 |
8.合成氨厂用氨气和空气的混合气体通过灼热铂-铑合金网发生氨氧化反应,若有标准状况下A L氨气完全反应.并转移电子数X个,则阿伏加德罗常数(NA)可表示为( )
| A. | $\frac{11.2X}{5A}$mol-1 | B. | $\frac{5A}{11.2X}$mol-1 | C. | $\frac{22.4A}{5X}$mol-1 | D. | $\frac{22.4X}{5A}$mol-1 |
6.下列萃取与分液结合进行的操作(用CCl4作萃取剂,从碘水中萃取碘)中错误的是( )
| A. | 饱和碘水和CCl4加入分液漏斗中后,塞上上口部的塞子,用一手压住分液漏斗上口部,一手握住活塞部分,把分液漏斗倒转过来振荡 | |
| B. | 静置,待分液漏斗中液体分层后,先使分液漏斗内外空气相通(准备放出液体) | |
| C. | 打开分液漏斗的活塞,使全部下层液体沿承接液体的烧杯内壁慢慢流出 | |
| D. | 最后继续打开活塞,另用容器承接并保存上层液体 |
7.在加热固体NH4Al(SO4)2•12H2O时,固体质量随温度的变化曲线如图所示:已知A点物质为NH4Al(SO4)2,B点物质为Al2(SO4) 3,下列判断正确的是( )
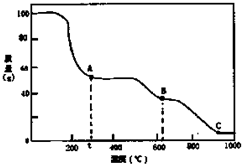

| A. | 0℃→t℃的过程变化是物理变化 | |
| B. | C点物质是工业上冶炼铝的原料 | |
| C. | A→B反应中生成物只有Al2(SO4)3和NH3两种 | |
| D. | Al2(SO4)3能够净水,其原理为:Al3++3OH?Al(OH)3 |