题目内容
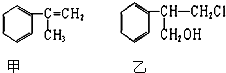
15. 镍及其化合物在合金材料以及催化剂等方面应用广泛.
镍及其化合物在合金材料以及催化剂等方面应用广泛.(1)(1)基态Ni原子的核外电子排布式为1s22s22p63s23p63d84s2;第二周期基态原子未成对电子数与Ni相同且电负性最小的元素是C(填元素符号).
(2)金属镍能与CO形成配合物Ni(CO)4,写出与CO互为等电子体的一种分子和一种离子的化学式N2、CN-;
(3)很多不饱和有机物在Ni催化下可与H2发生加成反应.
如①CH2=CH2、②HC≡CH、③
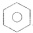 、④HCHO,其中碳原子采取sp2杂化的分子有①③④(填序号),HCHO分子的立体结构为平面三角形;HC≡CH分子内σ键与π键个数之比为3:2.
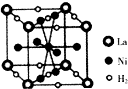
、④HCHO,其中碳原子采取sp2杂化的分子有①③④(填序号),HCHO分子的立体结构为平面三角形;HC≡CH分子内σ键与π键个数之比为3:2.(4)金属镍与镧(La)形成的合金是一种良好的储氢材料,如图是一种镍镧合金储氢后的晶胞结构示意图,该合金储氢后,含1molLa的合金可吸附H2的数目为3mol.
分析 (1)根据构造原理写出基态Ni原子核外电子排布式;Ni原子有2个未成对电子,第二周期有2个未成对电子的元素有C、O元素,同一周期,元素的电负性随着原子序数的增大而增大;
(2)等电子体中原子数相同、价电子数相同;
(3)根据碳原子含有的σ键和孤电子对判断碳原子采取的杂化方式; 根据价层电子对互斥理论判断甲醛的空间构型;共价单键为σ,共价双键中一个是σ一个是π键,共价三键中一个是σ两个是π键,
(3)根据均摊法计算晶胞中实际含有的粒子个数来解答.
解答 解:(1)Ni的原子序数为28,根据构造原理可写出电子排布式为:1s22s22p63s23p63d84s2,Ni原子有2个未成对电子,第二周期有2个未成对电子的元素是C和O元素,同一周期,元素的电负性随着原子序数的增大而增大,所以电负性较小的是C元素;
故答案为:1s22s22p63s23p63d84s2;C;
(2)CO含有2个原子、4+6=10个价电子,所以CO互为等电子体的一种分子和一种离子的化学式为:N2、CN-(或O22+、C22-、NO+),故答案为:N2;CN-;
(3)①CH2=CH2中每个碳原子含有3个σ键,不含孤电子对,所以采取sp2杂化,故①正确;
②HC≡CH中每个碳原子含有2个σ键,不含孤电子对,所以采取sp杂化,故②错误;
③ 中每个碳原子含有3个σ键,不含孤电子对,所以采取sp2杂化,故③正确;
中每个碳原子含有3个σ键,不含孤电子对,所以采取sp2杂化,故③正确;
④HCHO中碳原子含有3个σ键,不含孤电子对,所以采取sp2杂化,故④正确;
HCHO中碳原子含有3个σ键,不含孤电子对,所以其空间构型是平面三角形;
HC≡CH分子内σ键个数为3,π键个数为2,σ键与π键个数之比=3:2;
故答案为:①③④;平面三角;3:2;
(4)由晶胞可知,晶胞中La位于定点,平均含有8×$\frac{1}{8}$=1,Ni位于面心和体心,共含有8×$\frac{1}{2}$+1=5,H2位于边和面心,共有8×$\frac{1}{4}$+2×$\frac{1}{2}$=3,则含1mol La的合金可吸附H2的物质的量为3mol,故答案为:3mol.
点评 本题考查较综合,涉及晶胞计算、原子核外电子排布、原子杂化方式判断、空间构型等知识点,这些都是高考高频点,注意知识的灵活运用.

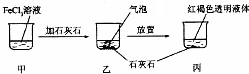
| A. | 反应过程中产生的气体是CO2 | |
| B. | 丙中液体可产生“丁达尔效应” | |
| C. | 若忽略溶液体积的变化,烧杯中c(Cl- )不发生变化 | |
| D. | 若在丙中加入过量盐酸,充分反应后所得溶液组成与甲相同 |
| A. | 饱和碘水和CCl4加入分液漏斗中后,塞上上口部的塞子,用一手压住分液漏斗上口部,一手握住活塞部分,把分液漏斗倒转过来振荡 | |
| B. | 静置,待分液漏斗中液体分层后,先使分液漏斗内外空气相通(准备放出液体) | |
| C. | 打开分液漏斗的活塞,使全部下层液体沿承接液体的烧杯内壁慢慢流出 | |
| D. | 最后继续打开活塞,另用容器承接并保存上层液体 |
①羟基的电子式:[
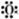 H]-
H]-②次氯酸分子的结构式:H-O-Cl
③乙烯的最简式(实验式):CH2=CH2
④含有10个中子的氧原子:${\;}_{8}^{16}$O
⑤铝离子的结构示意图:
⑥二氧化碳分子的比例模型:

| A. | 2个 | B. | 3个 | C. | 4个 | D. | 5个 |
| 溶液 | a | b | c | d | e |
| 溶质 | CH3COONa | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 11.6 | 10.3 | 11.1 | 11.3 |
(1)上述c和d溶液所含溶质对应的酸其酸性强弱为HClO>HCN(用化学式表示);
(2)结合表中数据分析,常温下与溶质a对水的电离程度影响相同的是B;
A.pH=8.8的NaOH溶液
B.pH=5.2的NH4Cl溶液
C.pH=5.2的盐酸
D.0.2mol•L-1的NaCN溶液
(3)用离子方程式表示c溶液呈碱性的原因是ClO-+H2O?HClO+OH-.
(4)如果将b溶液加入到含相同物质的量的BaCl2和ZnCl2的混合稀溶液中,首先析出的沉淀是ZnCO3[已知K(BaCO3)=5.1×10-9,K(ZnCO3)=1.4×10-11].
(5)浓度为0.1mol•L-1的e中离子浓度由大到小的顺序为c(Na+)>c(C6H5O?)>c(OH-)>c(H+).
(6)100℃时纯水中c(H+)=10-6mol•L-1,在此温度下某浓度的d溶液的pH=n,则c(H+)+c(HCN)=10n-12mol•L-1 .
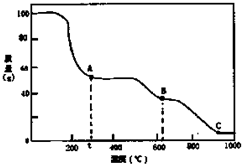
| A. | 0℃→t℃的过程变化是物理变化 | |
| B. | C点物质是工业上冶炼铝的原料 | |
| C. | A→B反应中生成物只有Al2(SO4)3和NH3两种 | |
| D. | Al2(SO4)3能够净水,其原理为:Al3++3OH?Al(OH)3 |