题目内容
19.有钠、镁、铝各n mol,分别与等体积、均与含xmolHCl的盐酸反应,下列说法不正确的是( )| A. | x<n时,钠生成的氢气最多 | B. | x=n时,钠、镁、铝生成的氢气一样多 | ||
| C. | n<x≤2n时,生成的氢气钠<镁=铝 | D. | x≥2n时,生成的氢气钠<镁<铝 |
分析 钠可与水反应,盐酸不足,Mg、Al生成氢气相当,但小于钠与水反应生成的氢气,结合2Na~2HCl~H2,2Mg~4HCl~2H2,2Al~6HCl~3H2,以此解答.
解答 解:A、x<n时,则盐酸少量,又钠与水反应生成的氢气,所以钠生成的氢气最多,故A正确;
B、x=n时,则钠刚好与盐酸反应,镁、铝与盐酸反应都是盐酸少量,所以生成的氢气都由盐酸中的氢生成,故一样多,故B正确;
C、n<x≤2n时,则钠与盐酸反应盐酸过量,镁、铝与盐酸反应都是盐酸少量,所以生成的氢气钠<镁=铝,故C正确;
D、x>3n时,则钠、镁、铝与盐酸反应盐酸都过量,所以生成的氢气钠<镁<铝;
但当x=2n,镁与盐酸刚好反应,铝与盐酸反应盐酸少量,生成的氢气镁=铝,故D错误;
故选D.
点评 本题考查钠的性质,注意钠和水反应的特点,根据物质的量的大小可与酸、水反应的特点比较生成氢气的多少,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.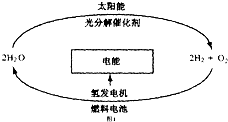 能源在各个方面的重要作用,科学家预测“氢能”将是人类社会最理想的新能源,目前,有人提出一种最经济最理想的获得氢能源的循环体系,如图所示.下列说法错误的是( )
能源在各个方面的重要作用,科学家预测“氢能”将是人类社会最理想的新能源,目前,有人提出一种最经济最理想的获得氢能源的循环体系,如图所示.下列说法错误的是( )
 能源在各个方面的重要作用,科学家预测“氢能”将是人类社会最理想的新能源,目前,有人提出一种最经济最理想的获得氢能源的循环体系,如图所示.下列说法错误的是( )
能源在各个方面的重要作用,科学家预测“氢能”将是人类社会最理想的新能源,目前,有人提出一种最经济最理想的获得氢能源的循环体系,如图所示.下列说法错误的是( )| A. | 在氢能的利用过程中,H2O可循环使用 | |
| B. | 开发和利用“氢能”,减少煤炭等化石能源的使用有助于控制臭氧空洞的形成 | |
| C. | 该法制氢的关键是寻找光分解催化剂 | |
| D. | 利用光电转化可将太阳能转化为电能用于电解水而获得氢气 |
7.下列反应的离子方程式正确的是( )
| A. | 向碳酸氢铵溶液中加入过量的氢氧化钠溶液:HCO3-+OH-═CO32-+H2O | |
| B. | 钠投入水中:Na+H2O═Na++OH-+H2↑ | |
| C. | 将少量二氧化碳通入水玻璃中:CO2+SiO32-+H2O═CO32-+H2SiO3↓ | |
| D. | 氯气通入水中:Cl2+H2O═2H++Cl-+ClO- |
14.下列有关性质的比较中,正确的是( )
| A. | 热稳定性:H2S>HCl>HBr>HI | B. | 熔点:Na2O>MgO>CaO | ||
| C. | 微粒半径:F-<Na+<Mg2+ | D. | 还原性:H2S>HCl>HF |
4.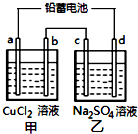 用铅蓄电池电解甲、乙电解池中的溶液.已知铅蓄电池的总反应为:
用铅蓄电池电解甲、乙电解池中的溶液.已知铅蓄电池的总反应为:
Pb(s)+PbO2(s)+2H2SO4(aq)$?_{放电}^{充电}$2PbSO4(s)+2H2O(l)
电解一段时间后向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是( )
 用铅蓄电池电解甲、乙电解池中的溶液.已知铅蓄电池的总反应为:
用铅蓄电池电解甲、乙电解池中的溶液.已知铅蓄电池的总反应为:Pb(s)+PbO2(s)+2H2SO4(aq)$?_{放电}^{充电}$2PbSO4(s)+2H2O(l)
电解一段时间后向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是( )
| A. | d极为阴极 | |
| B. | 放电时铅蓄电池负极的电极反应式为:PbO2(s)+4H+(aq)+SO42-(aq)+4e-═PbSO4(s)+2H2O(l) | |
| C. | 若利用甲池精炼铜,b极应为粗铜 | |
| D. | 若四个电极材料均为石墨,当析出6.4gCu时,两池中共产生气体3.36L(标准状况下) |
3.铝合金在日常生活、航空航天和汽车制造等方面均有广泛用途.下列关于铝的说法不正确的是( )
| A. | 铝的表面容易形成致密的氧化膜,抗腐蚀性能好 | |
| B. | 常温下不与任何碱反应 | |
| C. | 铝元素在地壳中的含量高,储量丰富 | |
| D. | 工业上可以用电解法冶炼铝 |
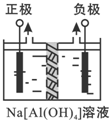 Al2O3、Al(OH)3都是重要化工原料.根据要求回答问题:
Al2O3、Al(OH)3都是重要化工原料.根据要求回答问题: