题目内容
14.X、Y是元素周期表中同一周期的两种元素,下列叙述能说明X的原子失电子能力比Y强的是( )| A. | X原子的最外层电子数比Y原子的最外层电子数多 | |
| B. | 原子半径:X>Y | |
| C. | 1mol X从酸中置换出来的氢比1mol Y从酸中置换出来的氢多 | |
| D. | X原子的最高正化合价比Y原子的最高正化合价高 |
分析 比较原子失电子能力可通过以下角度:①与水反应的剧烈程度,②最高价氧化物对应的水化物的碱性,③单质之间的置换反应,④对应阳离子离子的氧化性强弱等,⑤金属活动性顺序表.
解答 解:A.比较金属的活泼性不能根据最外层电子数的多少,如Al的最外层电子数比Na多,但不如Na活泼,故A错误;
B.比较金属的活泼性不能根据原子半径的大小,如Na的半径比铝的半径大,Na比铝活泼,能说明X的原子失电子能力比Y强,故B正确;
C.比较金属的活泼性不能根据生成氢气的多少来判断,例如1molAl从酸中置换H+生成的H2比1molMg从酸中置换H+生成的H2多,但Mg的活泼性强,故C错误;
D.氯的最高正化合价为+7价,而钠为+1价,但氯是非金属,得电子能力强,故D错误.
故选:B.
点评 本题考查金属的活泼性的比较,题目难度不大,注意能找出反例,学习中注意把握相关基础知识的积累.

练习册系列答案
相关题目
10. 能源在各个方面的重要作用,科学家预测“氢能”将是人类社会最理想的新能源,目前,有人提出一种最经济最理想的获得氢能源的循环体系,如图所示.下列说法错误的是( )
能源在各个方面的重要作用,科学家预测“氢能”将是人类社会最理想的新能源,目前,有人提出一种最经济最理想的获得氢能源的循环体系,如图所示.下列说法错误的是( )
 能源在各个方面的重要作用,科学家预测“氢能”将是人类社会最理想的新能源,目前,有人提出一种最经济最理想的获得氢能源的循环体系,如图所示.下列说法错误的是( )
能源在各个方面的重要作用,科学家预测“氢能”将是人类社会最理想的新能源,目前,有人提出一种最经济最理想的获得氢能源的循环体系,如图所示.下列说法错误的是( )| A. | 在氢能的利用过程中,H2O可循环使用 | |
| B. | 开发和利用“氢能”,减少煤炭等化石能源的使用有助于控制臭氧空洞的形成 | |
| C. | 该法制氢的关键是寻找光分解催化剂 | |
| D. | 利用光电转化可将太阳能转化为电能用于电解水而获得氢气 |
19.下列情况,不能用勒夏特列原理解释的是( )
| A. | H2、I2、HI平衡混合气体加压后颜色变深 | |
| B. | 夏天,打开冰镇啤酒瓶,立即冒出大量泡沫 | |
| C. | 生活中,用饱和碳酸钠溶液洗去锅碗瓢盆上的油污,且热溶液的效果更好 | |
| D. | 侯氏制碱工业中,降温析出副产品NH4Cl之前,向溶液中既撒NaCl固体又通入足量NH3 |
6.下列各组物质中化学键的类型相同的是( )
| A. | HCl MgCl2 NH4Cl | B. | H2O Na2O CO2 | ||
| C. | CaCl2 NaOH H2S | D. | NH3 H2O CO2 |
3.铝合金在日常生活、航空航天和汽车制造等方面均有广泛用途.下列关于铝的说法不正确的是( )
| A. | 铝的表面容易形成致密的氧化膜,抗腐蚀性能好 | |
| B. | 常温下不与任何碱反应 | |
| C. | 铝元素在地壳中的含量高,储量丰富 | |
| D. | 工业上可以用电解法冶炼铝 |
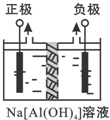 Al2O3、Al(OH)3都是重要化工原料.根据要求回答问题:
Al2O3、Al(OH)3都是重要化工原料.根据要求回答问题: