题目内容
10.设NA为阿伏加德罗常数的数值,下列说法错误的是( )| A. | NA 个氨气分子中含有3mol σ 键 | |
| B. | 18g水中含有NA 对孤电子对 | |
| C. | NA 个氮气分子中含有2mol π键 | |
| D. | NA 个二氧化碳分子中含有2mol π键 |
分析 A、1mol氨气中含3molN-H键;
B、求出水的物质的量,然后根据1mol水中含2mol孤电子对来分析;
C、共价三键中含有一个σ键、2个π键;
D、1mol二氧化碳中含2molπ键.
解答 解:A、NA个氨气分子的物质的量为1mol,而1mol氨气中含3molN-H键,即3mol σ 键,故A正确;
B、18g水的物质的量为1mol,而1mol水中含2mol孤电子对,即含2NA个孤电子对,故B错误;
C、共价三键中含有一个σ键、2个π键,氮气分子的结构式为N≡N,所以NA个氮气分子中含有1molσ键、2molπ键,故C正确;
D、NA个二氧化碳的物质的量为1mol,而1mol二氧化碳中含2molπ键,故D正确.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
20.下列相关反应的离子方程式书写正确的是( )
| A. | 将少量醋酸加入NaAlO2溶液中:CH3COOH+AlO${\;}_{2}^{-}$+H2═CH3COO-+Al(OH)3↓ | |
| B. | 将钠粒投入CuSO4溶液中:2Na+Cu2+═Cu+2Na+ | |
| C. | 将NaHSO4溶液滴加到含有酚酞的Ba(OH)2溶液中,溶液由红色变成无色:Ba2++OH-+H++SO${\;}_{4}^{2-}$═BaSO4↓+H2O | |
| D. | 硫化钠溶液中加入少量的氯化铁溶液:S2-+Fe3+═Fe2++S↓ |
1.下列说法中正确的是( )
| A. | 标准状况下,11.2L CCl4所含分子数为0.5NA | |
| B. | 56g Fe与足量的盐酸反应转移电子数为3NA | |
| C. | 1mol铁元素转化成氢氧化铁胶体后,便有NA个氢氧化铁胶体微粒 | |
| D. | 常温常压下,46g的NO2和N2O4混合气体含有的原子数为3NA |
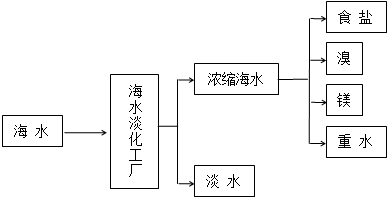
15.化合物A、B、C、D各由两种元素组成,甲、乙、丙是三种单质.这些常见的化合物与单质之间存在如图关系(已知化合物C是一种有机物),

以下结论不正确的是( )

以下结论不正确的是( )
| A. | 甲、乙、丙三种单质全是非金属 | |
| B. | 上述转化关系所涉及的化合物中有一种是电解质 | |
| C. | 上图所示的五个转化关系中,有三个是化合反应 | |
| D. | 上图所示的五个转化关系中,均为放热反应 |
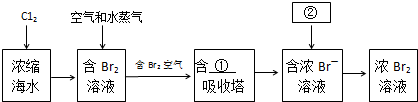
19.HPE是合成除草剂的重要中间体,其结构简式如图所示.下列有关HPE的说法正确的是( )
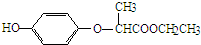
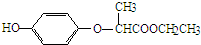
| A. | 含1mol HPE的溶液最多可以和2molNaOH反应 | |
| B. | HPE不能跟浓溴水反应 | |
| C. | 1molHPE能与4molH2发生加成反应 | |
| D. | HPE分子中最多有12个原子共平面 |
20.下列文字表述与反应方程式对应且正确的是( )
| A. | 用惰性电极电解饱和氯化钠溶液:2Cl-+2H+ $\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑ | |
| B. | 用醋酸除去水垢:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| C. | 利用腐蚀法制作印刷线路板:2Fe3++Cu═2Fe2++Cu2+ | |
| D. | 实验室用液溴和苯在催化剂作用下制溴苯: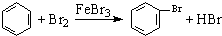 |
 .
.