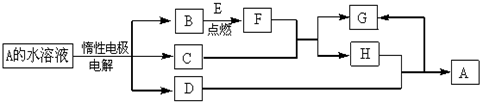
题目内容
1.下列说法中正确的是( )| A. | 标准状况下,11.2L CCl4所含分子数为0.5NA | |
| B. | 56g Fe与足量的盐酸反应转移电子数为3NA | |
| C. | 1mol铁元素转化成氢氧化铁胶体后,便有NA个氢氧化铁胶体微粒 | |
| D. | 常温常压下,46g的NO2和N2O4混合气体含有的原子数为3NA |
分析 A、标况下,四氯化碳为液态;
B、求出铁的物质的量,然后根据铁反应后为+2价来分析;
C、一个氢氧化铁胶粒是多个氢氧化铁的聚集体;
D、NO2和N2O4化学式最简比相同,只需计算46gNO2和中所含的原子数即可;
解答 解:A、标况下,四氯化碳为液态,故不能根据气体摩尔体积来计算,故A错误;
B、56g铁的物质的量为1mol,而铁与盐酸反应后为+2价,故1mol铁反应后失去2mol电子,即失去2NA个,故B错误;
C、一个氢氧化铁胶粒是多个氢氧化铁的聚集体,故1mol铁元素转化成氢氧化铁胶体后,故所得到的氢氧化铁胶体微粒的个数小于NA个,故C错误;
D、NO2和N2O4化学式最简比相同,只需计算46gNO2和中所含的原子数=$\frac{46g}{46g/mol}$×3×NA=3NA,故D正确;
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 导学全程练创优训练系列答案
导学全程练创优训练系列答案
相关题目
18.NA表示阿伏加德罗常数,下列说法错误的是( )
| A. | 1molNH3中含有6.02×1024个电子 | |
| B. | 1mol水中含有2mol氢和1mol氧 | |
| C. | 1molOH-中含有8mol中子 | |
| D. | 2.3g钠由原子变成离子时,失去的电子数为0.1NA |
12.下列关于Cl2性质的说法正确的是( )
| A. | 密度比空气小 | B. | 是无色无味的气体 | ||
| C. | 能使干燥的有色布条褪色 | D. | 可与NaOH溶液反应 |
16.将0.1mol N2和0.3mol H2置于密闭容器中发生反应:N2+3H2$?_{催化剂}^{高温、高压}$2NH3,下列关于该反应的说法中正确的是( )
| A. | 达到平衡后,这个反应就停止,正反应速率等于逆反应速率且为0 | |
| B. | 最终可生成0.2 mol NH3 | |
| C. | 升髙温度,反应速率增大 | |
| D. | 当V正(N2):V 正(H2)=1:3时,一定达化学平衡状态 |
13.下列离子方程式书写正确的是( )
| A. | 氢氧化钡溶液与稀硫酸反应:Ba2++SO42-+H++OH-=BaSO4↓+H2O | |
| B. | 淀粉碘化钾溶液在空气中变蓝:4I-+O2+2H2O=4OH-+2I2 | |
| C. | 磁性氧化铁溶于盐酸:Fe2O3+6H+=2Fe3++3H2O | |
| D. | 用氨水吸收足量的SO2气体:OH-+SO2=HSO3- |
10.设NA为阿伏加德罗常数的数值,下列说法错误的是( )
| A. | NA 个氨气分子中含有3mol σ 键 | |
| B. | 18g水中含有NA 对孤电子对 | |
| C. | NA 个氮气分子中含有2mol π键 | |
| D. | NA 个二氧化碳分子中含有2mol π键 |
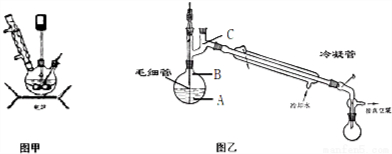 水合肼作为一种重要的精细化工原料,在农药、医药及有机合成中有广泛用途.用尿素法制水合肼,可分为两个阶段,第一阶段为低温氯化阶段,第二阶段为高温水解阶段,总反应方程式为:CO (NH2)2+NaClO+2NaOH→H2N-NH2•H2O+NaCl+Na2CO3.
水合肼作为一种重要的精细化工原料,在农药、医药及有机合成中有广泛用途.用尿素法制水合肼,可分为两个阶段,第一阶段为低温氯化阶段,第二阶段为高温水解阶段,总反应方程式为:CO (NH2)2+NaClO+2NaOH→H2N-NH2•H2O+NaCl+Na2CO3.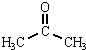 +CH3COOH
+CH3COOH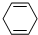
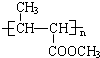 有一种合成这种高聚物的途径副产物污染少或无污染,原子利用率较高,符合“绿色化学挑战计划”的要求,其合成路线如下:
有一种合成这种高聚物的途径副产物污染少或无污染,原子利用率较高,符合“绿色化学挑战计划”的要求,其合成路线如下: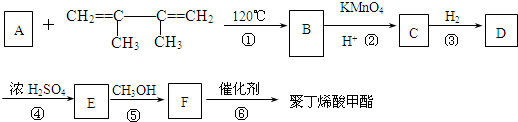
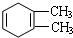 C:
C: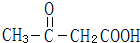
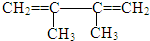 的系统命名名称是2,3-二甲基-1,3-丁二烯,反应⑥属于加聚反应(填反应类型)
的系统命名名称是2,3-二甲基-1,3-丁二烯,反应⑥属于加聚反应(填反应类型)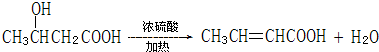 反应⑤:
反应⑤: